Las leyes de los gases




SEPTIEMBRE 8 DE 2014
¿QUIÉN MATO A NAPOLEÓN?
Chang Raymond
Química
McGraw Hill, 6ª Edición,
México 1999.
p. 152.
Después de su derrota en Waterloo, EN 1815 Napoleón fue exiliado en Santa Elena, una pequeña isla del océano Atlántico en donde pasó los últimos seis años de su vida. En la década de 1960 se analizaron muestras del cabello de Napoleón y se encontró que tenían una gran cantidad de arsénico lo cual sugería que pudiera haber sido envenenado, los principales sospechoso era el gobernador de Santa Elena, con quien Napoleón no se llevaba bien y la familia real francesa que querían evitar su regreso a Francia.
El arsénico elemental no es peligroso el veneno utilizado es en realidad el óxido de arsénico III, As2O3, un compuesto blanco que se disuelve en agua.
Que no tiene sabor y que es difícil detectar si se administra por largo tiempo. Alguna vez fue conocido como “el polvo de la herencia” por que se podía añadir al vino del abuelo para apresurar su muerte, y así ¡heredar los bienes!
En 1832 el Químico inglés James Marsh desarrolló un procedimiento para detectar arsénico. En esta prueba, que ahora lleva el nombre de Marsh, se combina el hidrógeno formado por la reacción entre zinc y ácido sulfúrico con una muestra del supuesto veneno. Si hay As2O3 presente, reacciona con el hidrógeno y forma arsina AsH3, un gas tóxico.
Cuando el gas arsina se calienta, se descompone y forma arsénico el cual se reconoce por su brillo metálico. La prueba de Marshes un medio de disuasión efectivo para evitar los homicidios con As2O3, pero se inventó demasiado tarde para ayudar a Napoleón (si es que en efecto hubiera sido victima de envenenamiento intencional con arsénico).
En los inicios de los años 1990, surgieron dudas acerca de la teoría de conspiración en la muerte de Napoleón debido a que se encontró que en una muestra de papel tapiz de su estudio contenía arsenato de cobre CuHSO4, un pigmento verde que se usaba comúnmente en esa época. Se ha sugerido que el clima húmedo de la isla promovido el crecimiento del moho en el tapiz
Es posible que para librarse del arsénico el moho lo convirtió en trimetilarsina (CH3). As un compuesto volátil y muy venenoso. La exposición prolongada a estos vapores explicaría la presencia de arsénico en su cuerpo, lo cual pudo haber deteriorado su salud aunque no haya sido la principal causa de su muerte. Esta interesante teoría se apoya en el hecho de que los visitantes asiduos de Napoleón sufrían trastornos gastrointestinales y otros síntomas de
envenenamiento con arsénico. Sin embargo su salud mejoraba cuando pasaba muchas horas trabajando en el jardín su principal.
Pasatiempo en la isla.
Tal vez nunca sabremos si napoleón murió por envenenamiento intencional o accidental con arsénico, pero este ejercicio de detectives históricos aporta un uso fascinante del análisis químico. El análisis químico no sólo se utiliza en la ciencia forense, sino que también juega un papel esencial en las investigaciones que abarca desde la investigación pura hasta las aplicaciones prácticas, como el control de productos comerciales y de diagnóstico clínico.
Pistas químicas:
1. E l arsénico en el pelo de Napoleón se detecto por medio de una técnica llamada activación de neutrones. Cuando el arsénico 75 es bombardeado con neutrones de alta energía, se convierte en el isótopo radiactivo As-76. La energía de los rayos gama emitidos por el isótopo es característica del arsénico, y la intensidad de los rayos determina cuanto arsénico se encuentra presente en la muestra. Con esta técnica, es posible detectar cantidades tan pequeñas como 5
nanogramos (5x10-9g.) por gramo de material.
2. El arsénico no es un elemento esencial para el cuerpo humano a:
A) Basándose en la posición que guarda en la tabla periódica,
proponga una causa de su toxicidad.
B) Aparte del cabello, ¿Dónde más se podría buscar la acumulación
del elemento si se sospecha de envenenamiento con arsénico?
3. La prueba de Marsh para el arsénico implica los siguientes pasos:
a) La generación de hidrógeno cuando se añade ácido sulfúrico al
zinc.
B) La reacción del hidrógeno con óxido de arsénico III para producir
arsina.
C) La transformación de arsina en arsénico por calentamiento.
Escriba las ecuaciones que representen estos casos e identifique el tipo de
reacción en cada uno
AGOSTO 11 DE 2014
TEMA PARA SERVICIO SOCIAL: VALORO MI CUERPO
recuerde la modalidad de grupo y este tópico le sirve para realizar la actividad y manejar el mismo idioma.
Algunos aspectos básicos para su cuidado son:
- Cuidar nuestra dieta o nutrición: es sin duda alguna una de las prioridades para nuestro organismo. Escoger una dieta equilibrada, lo más variada posible y que se amolde a nuestro clima, a nuestra constitución física y a nuestras necesidades nutricionales según nuestra actividad o requerimientos concretos.
- El Cuidado del cuerpo relacionado con la actividad física: el hecho de que nuestro trabajo sea cada vez más sedentario y que nos desplacemos a todas parte en automóvil u otro medio de transporte hace que la mayoría de las personas necesiten practicar una actividad física extra como el deporte. La necesidad de descargar el estrés y estirar nuestros músculos hace, por suerte, que la gente vuelva a interesarse por el ejercicio físico.
- Descansar lo necesario: parar de vez en cuando y simplemente no hacer nada es muy importante. La típica siesta es un claro ejemplo de remedio natural gratuito y de grandísima eficacia para nuestro cuerpo y mente. Dormir las horas adecuadas es básico si queremos sentirnos recargados de energía al despertar por la mañana.
- Aprender a escuchar a nuestro cuerpo: cuando tenemos algún dolor, alguna enfermedad o nos sentimos mal debemos pararnos e intentar escuchar que es lo qué nuestro cuerpo trata de decirnos. A menudo quiere decirnos que no estamos descansando lo suficiente, que estamos tomando demasiados excitantes (café, alcohol, etc.) o que estamos comiendo de un modo desordenado o desequilibrado. Una vez interpretado el mensaje deberíamos decirle que no hace falta que se enferme que ya vamos a corregir ese "desajuste". Un masaje, una siesta o una cena muy ligera pueden ser un buen regalo para este cuerpo tan sufrido.
- Necesidad de relajarnos: el deporte es sin duda una buena fuente de descarga del estrés, pero aquella persona que siente que necesita aún más cuidado del cuerpo (especialmente de su sistema nervioso) puede encontrar ayuda en alguna de las muchas técnicas de relajación que hay hoy en día (Yoga, taichi, Sofrología, Método Silva, visualizaciones, etc.)
- Sanar las emociones: la gente interesada en el cuidado del cuerpo ya sabe que sanar las emociones es quizá lo más importante ya que es uno de los "alimentos" que más nos nutren… o nos envenenan. Es muy importante, de vez en cuando, hacer balance de nuestras emociones e intentar resolver esos temas que tenemos pendientes con familiares, amigos, compañeros de trabajo o vecinos. La culpabilidad, la ira o el rencor son casi siempre un peso que nos impide caminar o avanzar en la vida.
- Compartir más tiempo con amigos y familia nos hace sentirnos queridos y disfrutar también de la posibilidad de poder expresarles a ellos lo que sentimos por ellos. No es suficiente en sentirlo. Al igual que a nosotros a los demás también les gusta oír que ellos también son especiales para nosotros.
- Alimentar nuestro espíritu: levantarnos y respirar profundamente dando gracias por el nuevo día puede ser un modo bien simple de empezar la jornada con una mejor motivación. Es muy importante cultivar nuestro crecimiento interior tratando de ser un poco mejores cada día. Sentir que somos parte del planeta y del mismo equipo que el resto de la humanidad. Tener una visión más amplia del concepto de familia y tratar a los demás como nos gusta ser tratados nosotros mismos.
AGOSTO 1 DE 2014
JULIO 16 DE 2014
SERVICIO SOCIAL OBLIGATORIO
TEMA: Enfermedades de la piel.
MATERIALES: lo necesario de acuerdo a la modalidad de
su grupo de trabajo.
Objetivo: motivar a los niños que mantengan un
adecuado aseo para evitar contagios que produzcan irritaciones de la piel.
Nadar en piscinas es una actividad divertida y saludable
pero puede ser origen de algunas enfermedades infecciosas como diarrea,
infecciones de los oídos, re La sequedad en la piel de los niños
puede ser la causa de la aparición de granitos. ¿Cómo debemos cuidar la piel
sensible y seca de los más pequeños?
La sequedad y sensibilidad de la piel son, sin duda, los
problemas que más consultan los padres al dermatólogo. Cuando el niño tiene la
piel seca sin más como mucho habría que hidratarle una o dos veces al día, e ir
observando y eligiendo la crema hidratante que más conviene a la piel del niño,
en particular.
Sin embargo, hay ciertas irritaciones cuyo tacto es áspero
y con frecuencia se confunde la sequedad con la inflamación de la piel, por lo
que el efecto de las cremas hidratantes es escaso y el niño no deja de tener la
piel inflamada por mucho que le hidratemos. En caso de una sequedad persistente
que se resuelve de ninguna manera y que,
con frecuencia, produce picor o escozor al niño cuando se le hidrata, habría
que consultar con el dermatólogo para estudiar la posibilidad de una dermatitis
sobreañadida o independiente de la sequedad. Estos cuadros requieren un
tratamiento específico que, a veces, incluye la retirada de la crema hidratante
por unos días o complementarla con un tratamiento específico. La terapia
depende de cada caso y del origen del eccema o irritación respiratoria, de la
piel, etc.
JULIO 9 de 2014
COMPROMISO
Realiza los siguientes ejercicios de nomenclatura en tu cuaderno de trabajo, teniendo en cuenta la nomenclatura stock, sistemática y tradicional o asignando la fórmula correcta según sea el caso:
Ejercicios
1 Zn(OH)2 1 Ozono
2 IF5 2 Cloruro de titanio(IV)
3 HI 3 Óxido de yodo(VII)
4 K2S 4 Ioduro de arsénico(III)
5 SiH4 5 Ioduro de cinc
6 NO 6 Hidruro de plomo
7 PtO2 7 Hidróxido de mercurio(I)
8 Au2S3 8 Agua
9 Br2O5 9 Bromuro de hidrógeno
10 SO3 10 Óxido de vanadio(V)
11 Fe(OH)3 11 Hidruro de litio
12 AlN 12 Óxido de litio
13 HgI2 13 Ioduro de radio
14 Co2O3 14 Óxido de magnesio
15 PCl3 15 Óxido de nitrógeno(III)
16 KH 16 Óxido de plata
17 Na2S 17 Óxido de fósforo(III)
18 Ca(OH)2 18 Fluoruro de aluminio
19 PbI2 19 Óxido de ber
20 FeO 20 Fluoruro de rubidio
http://cerezo.pntic.mec.es/~jrodr139/materiales/materiales_generales/Formulacion_inorganica.pdf
Servicio social obligatorio de julio 22.
Materiales: teniendo en cuenta la modalidad que escogiste prepara tus
materiales y los presentas el día viernes en la clase de Química.
El mosquito transmisor del dengue vive en los recipientes que contienen
agua dentro de la casa y en sus alrededores
Por eso, para prevenir la enfermedad es importante:
· Desechar todos los
objetos que no se utilicen que estén al aire libre y puedan acumular agua:
llantas viejas, latas, botellas, juguetes.
· Tapar los depósitos
de agua y cambiar diariamente el agua de
los bebederos de los
animales.
· Poner arena o tierra
húmeda en los floreros o cambiar el agua diariamente.
· Llenar con tierra o
arena los charcos y lugares donde se acumule agua de lluvia.
· Protegerse de las
picaduras con pantalones y remeras de manga larga; usar repelente sobre la piel
expuesta y sobre la ropa (repitiendo la aplicación cada 3 horas); y poner
mosquiteros en puertas y ventanas.
JUNIO 9 DE 2014
OBSERVA ATENTAMENTE:
MAYO 16 DE 2014
PROPIEDADES DEL GRUPO ALCALINO TERREO Y TÉRREOS.
MAYO 5 DE 2014
PROPIEDADES FÍSICAS Y QUÍMICAS DEL GRUPO I A
ABRIL 22 DE 2014
Configuración electrónica
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica. El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p. El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.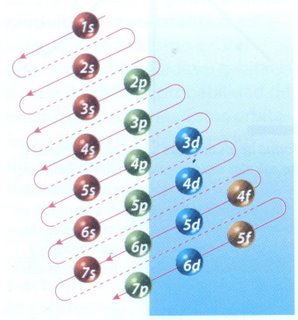

Escribiendo configuraciones electrónicas
Para escribir la configuración electrónica de un átomo es necesario:
- Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
- Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).
- Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Ejemplo:
Los orbitales se llenan en orden creciente de energía, con no más de dos electrones por orbital, según el principio de construcción de Aufbau.
Litio (Z = 3). Este elemento tiene 3 electrones. Empezaremos llenando el orbital de menor energía con dos electrones que tendrán distinto spin (ms). El electrón restante ocupará el orbital 2s, que es el siguiente con menor energía:

La flecha indica el valor del cuarto número cuántico, el de spin: para +1/2: y para –1/2, respectivamente.
También podemos describir la distribución de electrones en el átomo de litio como:

También podemos describir la distribución de electrones en el átomo de litio como:

MARZO 21 DE 2014
REALIZA LOS PROBLEMAS EN TU CUADERNO DE TRABAJO.
Problema 1:
Dada las siguientes proposiciones, indicar lo incorrecto.
a) La temperatura es una medida relativa del grado de agitación que posee las partículas que componen un cuerpo.
b) El cero absoluto es la temperatura a la cual teóricamente debe cesar todo movimiento.
c) La temperatura y el calor es lo mismo.
Problema 2:
La temperatura del cuerpo humano es 37°C. ¿A cuántos grados Farenheit equivale?
Problema 3:
Convierta las siguientes temperaturas como se indica:
- Convertir 1638 K a grados Celsius.
- Convertir 415°C a grados Kelvin.
- Convertir 68°F a grados Celsius.
- Convertir 537°F a grados Kelvin.
Para afianzar los conceptos y forma de hallar la densidad, la masa y el volumen de algunas sustancias resuelva los siguientes ejercicios:
1) Calcular la densidad en g/cm ³ de:
a) granito, si una pieza rectangular de 0,05 m x 0,1 m x 23 cm, tiene una masa de 3,22 kK
Respuesta: 2,8 g/cm ³
b) leche, si 2 litros tienen una masa de 2,06 kg.
Respuesta: 1,03 g/cm ³
c) cemento, si una pieza rectangular de 2 cm x 2 cm x 9 cm, tiene una masa de 108 g.
Respuesta: 3 g/cm ³
d) nafta, si 9 litros tienen una masa de 6.120 g.
Respuesta: 0,68 g/cm ³
e) Marfil, si una pieza rectangular de 23 cm x 15 cm x 15,5 cm, tienen una masa de 10,22 kg.
2) Calcular la masa de:
a) 6,96 cm ³ de cromato de amónio y magnesio si la densidad es de 1,84 g/cm ³.
Respuesta: 12,81 g
b) 86 cm ³ de fosfato de bismuto si la densidad es de 6,32 g/cm ³.
Respuesta: 543,42 g
c) 253 mm ³ de oro si la densidad es de 19,3 g/cm ³.
Respuesta: 4,88 g
3) Calcular el volumen de:
a) 3,37 g de cloruro de calcio si la densidad es de 2,15 g/cm ³.
Respuesta: 1,57 cm ³
b) 40,5 g de silicato de cromo si la densidad es de 5,5 g/cm ³.
Respuesta: 7,36 cm ³
c) 2,13 kg de estaño si la densidad es de 7,28 g/cm ³.
Respuesta: 292,58 cm ³
FEBRERO 13 DE 2014
Historia de la Química
Alrededor del año 2200 a.C. los chinos propusieron que la materia se componía de 5 elementos: metal, madera, tierra, fuego y agua.
Casi al mismo tiempo el conocimiento científico de los egipcios les permitió utilizar el oro, el cobre, los minerales de plomo y realizar alfarería.
La contribución de los griegos data de 600 a 200 años a.C. las contribuciones griegas fueron solo especulación ya que no llevaron a cabo ninguna experimentación.
Aristóteles estableció la idea de que el material terrestre estaba formado por 4 elementos: aire, tierra, fuego y agua. Así propuso un 5 elemento: la "quintaesencia" o "éter" el cual creía que forma gran parte de los cuerpos celestes. Democrito: Propuso una teoría sobre la estructura atómica de la materia.
Los alquimistas trataron de cambiar diversos materiales en oro. Ellos la piedra "filosofal" que creían se necesitaba para hacer este cambio. Su trabajo fue mas bien fantasía que realidad científica, y aunque fallaron en sus intentos de realizar transformaciones prepararon sustancias nuevas, desarrollaron técnicas novedosas y diseñaron muchos tipos de aparatos útiles.
Georg Ernst Stahl propuso la teoría del flogisto, que es el primer principio de la química. Stahl decía que todos los materiales combustibles contenían flogisto, el cual se libera al quemar la sustancia. La experimentación de la combustión como la combinación de la materia con el oxigeno del aire, fue lograda por Anotine Laurent Lavoisier. El trabajo de Lavoisier colocó a la química como una ciencia moderna.
Las grandes aportaciones a la química no se limitan a los siglos 18 y 19 si no que hoy en día se siguen produciendo en laboratorios industriales.
Algunos europeos que han tenido gran influencia son: Erwin Schrodingr desarrollo una ecuación matemática para describir las relaciones de energía que existen para el comportamiento de los electrones; Niel Bohr desarrollo un modelo atómico; Otto Hahn descubrio la fision Nuclear; Sir Robert Robinson sintetizó muchos compuestos útiles para la medicina en el tratamiento de varias enfermedades y postulo la estructura correcta de la compleja molécula de estricnina.
Rosalin Franklin desempeño importante papel en la determinación de la estructura del ADN. Dorothy Crowfoot Hodgking determino las estructuras de la vitamina B12 y la insulina.
|
FEBRERO 7 DE 2014
Con toda nuestra ilusión, les doy la bienvenida a este primer ciclo de estudio secundario: soy la profesora Divina Luz Púa Villa.
A través de este punto de encuentro compartiremos todo tipo de recursos que favorezcan los aprendizajes de ustedes, tanto de primaria como la secundaria.
Espero que este sea un espacio que disfruten como alumnos, sus padres y madres.
¡Así que pasen, vean y disfruten! La puerta está siempre abierta.
NOVIEMBRE 20 DE 2013
VÍDEO REALIZADO POR EL GRUPO DE ANDREA RODRIGUEZ, PARA DAR UN MERECIDO MENSAJE DE ALIENTO A LAS MUJERES CON CÁNCER DE SENO.
OCTUBRE 31 DE 2013
SOLUCIONES QUÍMICAS:
Las soluciones son sistemas homogéneosformados básicamente por dos componentes. Solvente y Soluto. El segundo se encuentra en menor proporción. La masa total de la solución es la suma de la masa de soluto mas la masa de solvente.
Las soluciones químicas pueden tener cualquier estado físico. Las más comunes son las líquidas, en donde el soluto es un sólido agregado al solvente líquido. Generalmente agua en la mayoría de los ejemplos. También hay soluciones gaseosas, o de gases en líquidos, como el oxígeno en agua. Las aleaciones son un ejemplo de soluciones de sólidos en sólidos.
La capacidad que tiene un soluto de disolverse en un solvente depende mucho de la temperatura y de las propiedades químicas de ambos. Por ejemplo, los solventes polares como el agua y el alcohol, están preparados para disolver a solutos iónicos como la mayoría de los compuestos inorgánicos, sales, óxidos, hidróxidos. Pero no disolverán a sustancias como el aceite. Pero este si podrá disolverse en otros solventes como solventes orgánicos no polares.
CONCENTRACION:
La concentración es la relación que existe entre la cantidad de soluto y la cantidad de solución o desolvente. Esta relación se puede expresar de muchas formas distintas. Una de ellas se refiere a los porcentajes.
Porcentaje masa en masa o peso en peso, (%m/m):Es la cantidad en gramos de soluto por cada 100 gramos de solución. Ej: Una solución 12% m/m tiene 12 gramos de soluto en 100 gramos de solución.
Como formula, podemos expresar esta relación así:
%m/m = x 100
Porcentaje masa en volumen (%m/v): Es la cantidad en gramos de soluto por cada 100 ml de solución. Aquí como se observa se combina el volumen y la masa. Ej: Una solución que es 8% m/v tiene 8 gramos de soluto en 100 ml de solución.
Fórmula: % m/v = x 100
Porcentaje volumen en volumen (%v/v): Es la cantidad de mililitros o centímetros cúbicos que hay en 100 mililitros o centímetros cúbicos de solución. Ej: Una solución 16% v/v tiene 16 ml de soluto por 100 ml de solución.
Fórmula: % v/v = x 100
Otras formas son la Molaridad, la Normalidad y la Molalidad.
Es bueno recordad antes el concepto de mol. El mol de una sustancia es el peso molecular de esa sustancia expresada en gramos. Estos datos se obtienen de la tabla periódica de los elementos.
Sumando las masas de los elementos se obtiene la masa de la sustancia en cuestión.
Molaridad: Es la cantidad de moles de soluto por cada litro de solución. Como fórmula:
M = n/V
M = M: Molaridad. n: Número de moles de soluto. V: Volumen de solución expresado en litros.
Normalidad: Es la cantidad de equivalentes químicos de soluto por cada litro de solución. Como fórmula:
N = n eq/V
N = Normalidad. n eq. : Número de equivalentes del soluto. V: Volumen de la solución en litros.
Molalidad: Es la cantidad de moles de soluto por cada 1000 gramos de solvente. En fórmula:
m = n/kgs solvente
m = Molalidad. n: Número de moles de soluto por Kg = 1000 gramos de solvente o 1 kg de solvente.
OCTUBRE 16 DE 2013
SERVICIO SOCIAL: BENEFICIOS DEL DEPORTE
LUGAR: COLEGIO POPYS
Hacer deporte es esencial para todos, pero en etapas de pleno desarrollo como la niñez, los beneficios son mucho más visibles tanto en el plano físico como en el emocional. Los niños que practican deportes suelen ser más fuertes, sanos, y además amigables y sociables.
Estas habilidades son accesibles para todos ellos, independientemente de si se destacan o no en su desempeño deportivo, ya que el deporte infantil no se basa preferentemente en la competencia sino en el fomentar el compañerismo. Teniendo en cuenta esto, no hay motivo para no animar a los más pequeños a hacer alguna actividad en la que tengan que mover el cuerpo e interactuar con los demás.
ESTA ES UNA LISTA DE ALGUNOS BENEFICIOS DEL DEPORTE: - Mejora la salud. Los deportes de por sí suelen ser actividades exigentes a nivel físico. El entrenamiento es muy bueno para el desarrollo corporal de nuestros niños y por ello para su salud. Asimismo, el practicar este tipo de actividades desde pequeños los inspira y les inculca el hábito de ser activos, costumbre que se vuelve muy importante de tener al día de hoy. Además, el hecho de hacer deporte regularmente ayuda a mantener las enfermedades alejadas y contribuye que nuestros chicos puedan gastar la energía suficiente y con ello estén más tranquilos y calmos lejos del estrés y la ansiedad.
- Confianza en sí mismo. Los niños que participan en la práctica de algún deporte tienen la oportunidad de aumentar la confianza en sí mismos, ya que de ellos depende el resto del equipo y viceversa. Este lazo de dependencia y de ayuda mutua ayuda a los niños a aprender a expresarse y además eleva su autoestima y su capacidad de relacionarse con los otros.
- Beneficios académicos. Las estadísticas muestran que los niños que practican deportes desde edades tempranas tienen mayores probabilidades de ser exitosos en el ámbito académico. Los deportes promueven una mejor gestión del tiempo debido a que desde pequeños los niños están obligados a combinar sus horas de estudio y de ejercicio de modo de cumplir con ambas cosas de manera eficaz. El deporte por otra parte, enseña a los niños a fijar metas y ello es muy importante también para su futuro estudiantil.
SEPTIEMBRE 24 DE 2013
EJERCICIOS PROPUESTOS
Realiza en tu cuaderno de trabajo:
1. A presión de 17 atm, 34 L de un gas a temperatura constante experimenta un cambio ocupando un volumen de 15 L ¿Cuál será la presión que ejerce?
2.-
Una cantidad de gas ocupa un volumen de 80 cm3 a una presión de 750 mm Hg. ¿Qué volumen
ocupará a una presión de 1,2 atm.si la temperatura no cambia?
3. El
volumen inicial de una cierta cantidad de gas es de 200 cm3 a la
temperatura de 20ºC .
Calcula el volumen a 90ºC
si la presión permanece constante.
4. Una cierta cantidad de gas se encuentra a la presión de 790 mm Hg cuando la
temperatura es de 25ºC .
Calcula la presión que alcanzará si la temperatura sube hasta los 200ºC .
SEPTIEMBRE 17 DE 2013
TEMA PARA DESARROLLAR EN VIDA SALUDABLE
ENFERMEDADES DE LA PIEL
Enfermedades de la Piel
Las alteraciones de la piel tienen diversos orígenes, y pueden ser causados por distintos factores externos tales como el sol, el viento, el agua clorada de las piscinas, el contacto con sustancias irritantes (químicos como por ejemplo los utilizados en la limpieza del hogar, insecticidas, herbicidas, pinturas), cremas, maquillajes de mala calidad y telas sintéticas, entre otros.
Otras causas pueden clasificarse como factores internos: Allí caben los problemas causados por algunos alimentos, reacción alérgica a medicamentos, intoxicación por sustancias químicas ingeridas tales como las contenidas en los cigarrillos, entre otros. También están las enfermedades cutáneas relacionadas con las alteraciones del metabolismo, aquellas causadas por patógenos (virus, bacterias y hongos) y algunas otras cuyas causas se ignoran.
Enfermedades Más Frecuentes:
Acné
Es una enfermedad que afecta a un 85 % de la población adolescente, sin embargo, puede aparecer en cualquier momento de la vida según factores genéticos, hormonales, laborales y psicológicos, tanto en hombres como en mujeres. Empieza a manifestarse entre los 10 y 14 años y siempre merece atención ya que en esta etapa la autoestima es muy importante. Erróneamente se considera algo "de la edad" y la enfermedad avanza incluso llegando a producir cicatrices permanentes.
Lunares
Son tumores benignos derivados de los melanocitos (células que producen la pigmentación de la piel) muy frecuentes, que pueden aparecer desde el nacimiento hasta la vida adulta de acuerdo a factores genéticos y exposición solar. Son pequeñas manchas o elevaciones de color café que se ubican en cualquier parte del cuerpo. El mayor riesgo de ellos es su transformación a melanoma, tumor maligno muy agresivo derivado de la misma célula, que se caracteriza por su rápido crecimiento, color negro y forma irregular, muy diferente a los lunares comunes.
Hongos
Los hongos son microorganismos que producen enfermedad en el hombre cuando consiguen penetrar o vencer las barreras defensivas naturales de la piel, por ejemplo, después un traumatismo o contacto con un animal infectado.Pueden afectar a niños y adultos y se localizan en la piel (tiña corporis), pelo (tiña capitis), o en las uñas (onicomicosis). En algunos casos, es transmitido en duchas públicas cuando no se toman medidas de precaución (pie de atleta).
Dermatitis
Este término se refiere a la inflamación de la piel por diferentes causas queprovocan enrojecimiento, granos y mucha picazón.
Lo Que Usted Puede Hacer Para Protegerse:
Aquí se mencionan algunas recomendaciones que usted puede seguir para proteger su piel:
- Use guantes, delantales y otras prendas protectoras para impedir que su piel entre en contacto con aceites, grasas y sustancias químicas.
- Vístase con ropa limpia para ir al trabajo, y enseguida, después del trabajo quítese la ropa que esté sucia con aceite o sustancias químicas.
- No se limpie las manos ni otras áreas de la piel con gasolina, kerosene, esencias minerales o trementina.
- Después de lavarse las manos protéjase la piel con vaselina, una loción o una crema.
- Sepa qué debe hacer si su piel entra en contacto con un material peligroso: Cómo quitarse el material de la piel y cómo obtener asistencia médica.
- No coma, beba ni fume en su lugar de trabajo. Hacerlo podría poner sustancias químicas en contacto cercano con su piel.
- Si usted trabaja al aire libre, póngase crema protectora solar varias veces al día. Además, use lentes de sol, un sombrero de ala ancha y una camisa o chaqueta manga larga.
TOMADO DE: SALUD Y MEDICINAS. http://www.saludymedicinas.com.mx/centros-de-salud/dermatologia/articulos/rosacea-cameron-diaz.html
Septiembre 12 de 2013
Gases y sus propiedades.
El estado gaseoso es un estado disperso de la materia, es decir , que las moléculas del gas están separadas unas de otras por distancias mucho mayores del tamaño del diámetro real de las moléculas. Resuelta entonces, que el volumen ocupado por el gas(V) depende de la presión (P), la temperatura (T) y de la cantidad o numero de moles ( n).
Las propiedades de la materia en estado gaseoso son:
 |
| Recipentes de gas. |
1. Se adaptan a la forma y el volumen del recipiente que los contiene. Un gas, al cambiar de recipiente, se expande o se comprime, de manera que ocupa todo el volumen y toma la forma de su nuevo recipiente.
2. Se dejan comprimir fácilmente. Al existir espacios intermoleculares, las moléculas se pueden acercar unas a otras reduciendo su volumen, cuando aplicamos una presión.
3. Se difunden fácilmente. Al no existir fuerza de atracción intermolecular entre sus partículas, los gases se esparcen en forma espontánea.
4. Se dilatan, la energía cinética promedio de sus moléculas es directamente proporcional a la temperatura aplicada.
Variables que afectan el comportamiento de los gases
1. PRESIÓN
Es la fuerza ejercida por unidad de área. En los gases esta fuerza actúa en forma uniforme sobre todas las partes del recipiente.
La presión atmosférica es la fuerza ejercida por la atmósfera sobre los cuerpos que están en la superficie terrestre. Se origina del peso del aire que la forma. Mientras más alto se halle un cuerpo menos aire hay por encima de él, por consiguiente la presión sobre él será menor.
2. TEMPERATURA
 |
| Volumen de un gas. |
Es una medida de la intensidad del calor, y el calor a su vez es una forma de energía que podemos medir en unidades de calorías. Cuando un cuerpo caliente se coloca en contacto con uno frío, el calor fluye del cuerpo caliente al cuerpo frío.
La temperatura de un gas es proporcional a la energía cinética media de las moléculas del gas. A mayor energía cinética mayor temperatura y viceversa.
La temperatura de los gases se expresa en grados kelvin.
3. CANTIDAD
La cantidad de un gas se puede medir en unidades de masa, usualmente en gramos. De acuerdo con el sistema de unidades SI, la cantidad también se expresa mediante el número de moles de sustancia, esta puede calcularse dividiendo el peso del gas por su peso molecular.
4. VOLUMEN
Es el espacio ocupado por un cuerpo.
5. DENSIDAD
Es la relación que se establece entre el peso molecular en gramos de un gas y su volumen molar en litros.
Gas Real
Los gases reales son los que en condiciones ordinarias de temperatura y presión se comportan como gases ideales; pero si la temperatura es muy baja o la presión muy alta, las propiedades de los gases reales se desvían en forma considerable de las de gases ideales.
JUNIO 11 DE 2013
NOTA: SE REALIZARON LAS PUBLICACIONES DE LAS CALIFICACIONES DE QUÍMICA DE II PERIODO.
JUNIO 7 DE 2013
CINE FORO
El día 6 de junio se llevó a cabo el cine-foro con motivo del Día Internacional del Medio Ambiente, por lo tanto desarrolla las siguientes preguntas en tu cuaderno de trabajo:
¿A qué se deben los Maremotos o Tsunamits?
¿En qué ciudades o paises se presentó?
¿Cuántas personas aproximadamente perecieron?
Realiza un mapa y delimita en qué zonas se han presentado hasta este momento.
¿Qué opinión tienes de la actividad?
NOTA: les hago una invitación especial a mis estudiantes que se dediquen a comprometerse con sus actividades, tomar en serio cada una de las indicaciones y venir con ánimo para el nuevo semestre, además, felicito aquellos jóvenes que han alcanzado los logros , continúen así.
PARA TODOS UNAS FELICES VACACIONES
MAYO 29 DE 2013
Nomenclatura química
los números de oxidación de los átomos en diferentes especies químicas cuyas fórmulas se dieron como dato. Ahora invertiremos el proceso, es decir, que conociendo los estados de oxidación se podrá deducir la fórmula química, y a partir de ella el nombre de la especie.
Se seguirán las reglas dictadas por la IUPAC (Unión Internacional de Química Pura y Aplicada). En las fórmulas, la porción positiva de un compuesto se escribe en primer término, a excepción de algunas especies que por su uso difundido se mantienen con la formulación tradicional. Tal es el caso, entre otros, del amoníaco, NH3; del ión amonio, NH4+; del metano, CH4. En cuanto a la nomenclatura, subsisten diferentes sistemas en uso, aunque es recomendable la utilización de la nomenclatura sistemática, ya que aún sin mayores conocimientos puede ser deducida a partir de la fórmula química; o en el caso inverso, dada la nomenclatura, puede escribirse la fórmula correspondiente.
A continuación puede visitar los siguientes link, y obtendrás una amplia información:
http://aprendeenlinea.udea.edu.co/lms/ocw/mod/resource/view.php?inpopup=true&id=244
http://dfbgquimica.webcindario.com/nomenclatura.html
MAYO 9 DE 2013
PARA DESARROLLAR EN EL CUADERNO DE TRABAJO.
RESPONDE:
1. Escriba los elementos químicos que hacen parte de los grupos estudiados en clase.
2. Mencione una característica especial para cada elemento químico.
3. ¿Qué aplicación industrial resalta de: Li, Na, K, Mg, Al.
4. ¿Cuál es el elemento químico que más captó su atención y por qué?
MAYO 2 DE 2013
AMPLÌA LA HISTORIA DE LA TABLA PERIODICA
http://www.uv.es/bertomeu/material/clasico/newlands.htm
http://20874.tudocente.com/page/5/
ABRIL 26 DE 2013
COMPROMISO
Escribe la confi guraci ón electr ónica (notaci ón espectral y diagrama básico) de los siguientes ele-
mentos: Cu, Br, Rb y Al.
ABRIL 11 DE 2013
Los Modelos Atómicos
Modelo Atómico de Dalton

Este Introduce la idea de la discontinuidad de la materia, es decir, es la primera teoría científica que considera que la materia está dividida en átomos. Los postulados básicos de esta teoría son:
- La materia está dividida en unas partículas indivisibles e inalterables llamadas átomos.
- Los átomos son partículas muy pequeñas y no se pueden ver a simple vista.
- Todos los átomos de un mismo elemento son iguales entre sí, igual masa e iguales propiedades.
- Los átomos de distintos elementos tienen distinta masa y distintas propiedades.
- Los compuestos se forman cuando los átomos se unen entre sí, en una relación constante y sencilla.
- En las reacciones químicas los átomos se separan o se unen; pero ningún átomo se crea ni se destruye, y ningún átomo de un elemento se convierte en átomo de otro elemento.
- Esta concepción se mantuvo casi durante un siglo
Modelo Atómico de Thompson

Posteriormente, en el año 1897 se descubre el electrón, una de las partículas subatómicas que conforma el átomo. En 1898 Thompson propuso un modelo atómico que tomaba en cuenta la existencia de dicha partícula subatómica. Su modelo era estático, ya que suponía que los electrones estaban en reposo dentro del átomo, y que el conjunto era eléctricamente neutro.
El modelo de Thompson era parecido a un pastel de frutas: los electrones estaban incrustados en una masa esférica de carga positiva. La carga negativa total de los electrones era la misma que la carga total positiva de la esfera, por lo que dedujo que el átomo era neutro.
El modelo de Thompson era parecido a un pastel de frutas: los electrones estaban incrustados en una masa esférica de carga positiva. La carga negativa total de los electrones era la misma que la carga total positiva de la esfera, por lo que dedujo que el átomo era neutro.
Thomson también explicó la formación de iones, tanto positivos como negativos.
Cuando el átomo pierde algún electrón, la estructura queda positiva y se forman iones positivos; pero si el átomo gana algún electrón, la estructura queda negativa y se forman iones negativos.
Cuando el átomo pierde algún electrón, la estructura queda positiva y se forman iones positivos; pero si el átomo gana algún electrón, la estructura queda negativa y se forman iones negativos.
Modelo Atómico de Rutherford

En 1911, Rutherford empleó las partículas alfa para determinar la estructura interna de la materia. A partir de ese experimento dedujo que:
- La mayoría de las partículas atraviesan la lámina sin desviarse (99,9%).
- Algunas partículas se desvían (0,1%).
- Núcleo: aquí se concentra casi la totalidad de la masa del átomo, y tiene carga positiva.
- Corteza: está formada por los electrones, que giran alrededor del núcleo describiendo órbitas circulares (sistema solar en miniatura)
Así mismo, también dijo que la materia es neutra, ya que la carga positiva del núcleo y la negativa de la corteza se neutralizan entre sí.
Rutherford dedujo que:
Rutherford dedujo que:
- La materia está casi vacía; el núcleo es 100.000 veces más pequeño que el radio del átomo.
- La mayoría de las partículas alfa no se desvían porque pasan por la corteza, y no por el núcleo.
- Las que pasan cerca del núcleo se desvían porque son repelidas.
- Cuando el átomo suelta electrones, el átomo se queda con carga negativa, convirtiéndose en un ión negativo; pero si, por el contrario, el átomo gana electrones, la estructura será positiva y el átomo se convertirá en un ión negativo.
- El átomo es estable.
Modelo Atómico de Böhr

- El átomo está cuantizado, ya que solo puede poseer unas pocas y determinadas energías.
- El electrón gira en unas órbitas circulares alrededor del núcleo, y cada órbita es un estado estacionario que va asociado a un numero natural, "n" (núm. cuántico principal), y toma valores del 1 al 7.
- Así mismo, cada nivel "n" está formado por distintos subniveles, "l". Y a su vez, éstos se desdoblan en otros (efecto Zeeman), "m". Y por último, hay un cuarto núm. cuántico que se refiere al sentido, "s".
- Los niveles de energía permitidos son múltiplos de la constante de planck.
- Cuando un electrón pasa de un nivel de energía a otro, se absorbe o se emite energía. Cuando el electrón está en n=1 se dice que está en el nivel fundamental (nivel de mínima energía); al cambiar de nivel el electrón absorbe energía y pasa a llamarse electrón excitado.
- Böhr situó a los electrones en lugares exactos del espacio.
- Es el modelo planetario de Böhr.
Modelo Mecano - Cuántico
Es el modelo actual; fue expuesto en 1925 por Heisenberg y Schrödinger.



Aspectos característicos:
Dualidad onda-partícula: Broglie propuso que las partículas materiales tienen propiedades ondulatorias, y que toda partícula en movimiento lleva una onda asociada.
Principio de indeterminación: Heisenberg dijo que era imposible situar a un electrón en un punto exacto del espacio.
Las ecuaciones del modelo mecano-cuántico describen el comportamiento de los electrones dentro del átomo, y recogen su carácter ondulatorio y la imposibilidad de predecir sus trayectorias exactas.
Así establecieron el concepto de orbital, región del espacio del átomo donde la probabilidad de encontrar un electrón es muy grande.
Características de los orbitales:
Dualidad onda-partícula: Broglie propuso que las partículas materiales tienen propiedades ondulatorias, y que toda partícula en movimiento lleva una onda asociada.
Principio de indeterminación: Heisenberg dijo que era imposible situar a un electrón en un punto exacto del espacio.
Las ecuaciones del modelo mecano-cuántico describen el comportamiento de los electrones dentro del átomo, y recogen su carácter ondulatorio y la imposibilidad de predecir sus trayectorias exactas.
Así establecieron el concepto de orbital, región del espacio del átomo donde la probabilidad de encontrar un electrón es muy grande.
Características de los orbitales:
- La energía está cuantizada.
- Lo que marca la diferencia con el modelo de Böhr es que este modelo no determina la posición exacta del electrón, sino la mayor o menor probabilidad.
- Dentro del átomo, el electrón se interpreta como una nube de carga negativa, y dentro de esta nube, en el lugar en el que la densidad sea mayor, la probabilidad de encontrar un electrón también será mayor.
- El comportamiento de los electrones dentro del átomo se describe a través de los números cuánticos
- Los números cuánticos se encargan del comportamiento de los electrones, y la configuración electrónica de su distribución.
- Y por último, dada la cantidad de elementos, se necesitaba una clasificación. Hoy en día se utiliza la Tabla Periódica, aunque le precedieron muchos otras propuestas. En la Tabla Periódica los elementos se clasifican según el número atómico.
MARZO 20 DE 2013
MEDIDA DE LA TEMPERATURA
La temperatura se mide con los termómetros. Los termómetros tradicionales de mercurio contienen un bulbo, ensanchamiento, en su base relleno de mercurio. Este bulbo se prolonga en un tubo capilar. El aumento de temperatura ocasiona una dilatación del mercurio y el mayor o menor ascenso por el capilar. El mismo procedimiento siguen los termómetros de alcohol.
Las unidades de medida de la temperatura son los grados que pueden ser: grados centígrados, grados Kelvin o grados Farenheitt.
La equivalencia entre grados centígrados y Kelvin se consigue sumando 273 º a los grados centígrados obteniéndose la temperatura en grados Kelvin.

CALOR Y EQUILIBRIO TÉRMICO
El calor es un tipo de energía térmica pero es la energía térmica que se transfiere de un cuerpo a otro. Siempre se transfiere desde el cuerpo de mayor temperatura al de menor temperatura, independientemente de sus tamaños relativos.
La transferancia de calor entre dos cuerpos se produce hasta que se alcanza equilibrio térmico que se consigue cuando se igualan las temperaturas de ambos.
Las unidades de calor se miden en unidades de energía, por lo tanto se miden en julios aunque tradicionalmente se han medido en calorías. La equivalencia entre ambas unidades es:
1 caloría = 4,184 julios

TRANSFERENCIA DE CALOR
El calor puede transferirse de un cuerpo o sistema material a
otro de varios modos:
- Conducción: transmisión en sólidos.
- Convección: transmisión en fluidos: líquidos, gases o sólidos con gran plasticidad.
- Radiación: a través de radiaciones electromagnéticas que pueden transferir el calor a través del vacío.
FEBRERO 13 DE 2013
EVALUANDO COMPETENCIAS
Observa el siguiente vídeo y escribe una conclusión en tu cuderno de trabajo:
NOVIEMBRE 14 DE 2012
CLAUSURA DE PROYECTO DE VIDA SALUDABLE 2012.
OCTUBRE 24 DE 2012
ACTIVIDAD EN CASA
DESARROLLA LOS SIGUIENTES EJERCICIOS:
1.Un tanque contiene metanoCH4 a 30o C y una presión de 5 atm. ¿Cuál es la presión interna del gas cuando se calienta el tanque a 35 oC?
2. Una muestra de SO3 ocupa un volumen de 3 litros en un recipiente cerrado a 150oC y 970 mm Hg. ¿Cuál es la temperatura, si la presión aumentó a 2.5 atm?
3. Una muestra de vapor de agua se encuentra a 180oC y 1 atm de presion. Si se disminuye la temperatura a 378oK. ¿A qué presión se encuentra el gas?
4. Una masa de O2 ocupa 3 litros a una presión de 710 mm Hg. ¿Cuál es el volumen de la misma masa del gas a presión normal (760 mm Hg), si permanece constante la temperatura?
OCTUBRE 18 DE 2012
TEMA: ¿POR QUÉ ES IMPORTANTE TENER UNOS DIENTES SANOS?
MATERIALES: cepillo de dientes, crema dental, afiches o ilustraciones de los dientes.
Por qué es importante tener unos dientes sanos?
¿Por qué te interesa cuidarte los dientes? Si te cuidas los dientes, ayudarás a prevenir la formación de la placa dental, que es una capa muy fina que se pega a los dientes. Tal vez no te preocupe demasiado el hecho de tener placa dental, pero el problema es que es muy pegajosa y actúa como un imán para las bacterias y el azúcar.
Como las hormigas en un picnic, las bacterias se enloquecen por el azúcar que tienes en los dientes y lo descomponen en ácidos que destrozan el esmalte dental, provocando la formación de unos agujeros en los dientes denominados caries. La placa dental también provoca gingivitis, una enfermedad en la que las encías se enrojecen, inflaman y duelen. Las encías son el tejido rosa y blando que tienes en la boca y que sujeta los dientes.
Si no te cuidas los dientes, no tardarás mucho en tener caries y dolor de encías. Lo pasarás mal al comer y, desde luego, no te apetecerá mucho sonreír.
Antes de que se inventara la pasta de dientes
Tenemos una gran suerte de saber tanto sobre cómo cuidarnos los dientes.
Antiguamente, cuando la gente se hacía mayor, se le iban cayendo los dientes a trozos, lo que era muy doloroso. Para librarse del dolor de dientes, se los tenían que sacar. Al final, la gente aprendió que era importante lavarse los dientes, pero todavía no se había inventado la pasta de dientes.
Mientras te lavas los dientes con tu pasta de dientes con sabor a menta fresca, piensa en las cosas que utilizaba antes la gente para lavarse los dientes:
• tiza o carbón en polvo
• zumo de limón
• ceniza (ya sabes, lo que queda tras un incendio)
• una mezcla de tabaco y miel.
¿Cómo puedes tener unos dientes sanos?
Los niños pueden cuidarse los dientes siguiendo los siguientes pasos:
• Lávatelos por lo menos dos veces al día -después de desayunar y antes de acostarte por la noche. Si puedes, lávatelos también después de la comida. Lavarse bien los dientes ayuda a descomponer la placa dental.
• Cepíllate todos los dientes, no solamente los que están delante y se ven más. Dedica un tiempo a los dientes laterales y a la cara interna de todos ellos. No te cepilles las encías.
• Dedica tiempo a lavarte los dientes, por lo menos tres minutos cada vez. Si te cuesta calcular el tiempo, utiliza un cronómetro o ponte una canción que te guste para ayudar a pasar el tiempo.
• Asegúrate de que tu cepillo de dientes es de cerdas suaves (en el envoltorio pondrá si es suave, medio o duro). Pide a tus padres que te cambien el cepillo de dientes cada tres meses. Las cerdas de algunos cepillos cambian de color cuando toca cambiar de cepillo.
• Aprende a utilizar seda dental.
• ¡También puede cepillar la lengua para ayudar a mantener el aliento fresco!
OCTUBRE 17 DE 2012
Teoría Cinético-Molecular de los Gases
En 1738 Daniel Bernouilli dedujo la
Ley de Boyle aplicando a las moléculas las leyes del movimiento de Newton, pero
su trabajo fue ignorado durante más de un siglo.
Los experimentos de Joule
demostrando que el calor es una forma de energía hicieron renacer las ideas
sostenidas por Bernouilli y en el período entre 1848 y 1898, Joule, Clausius,
Maxwell y Boltzmann desarrollaron la teoría cinético-molecular, también llamada
teoría cinética de los gases, que se basa en la idea de que todos los
gases se comportan de la misma manera en lo referente al movimiento molecular.
En 1905 Einstein aplicó la teoría
cinética al movimiento browniano de una partícula pequeña inmersa en un fluido
y sus ecuaciones fueron confirmadas por los experimentos de Perrín en 1908,
convenciendo de esta forma a los energéticos de la realidad de los
átomos. La teoría cinética de los gases utiliza una descripción molecular para
explicar el comportamiento macroscópico de la materia y se basa en los
siguientes postulados:
1. Las sustancias están
constituidas por moléculas pequeñísimas ubicadas a gran distancia entre sí; su
volumen se considera despreciable en comparación con los espacios vacíos que
hay entre ellas.
2. Las moléculas de un gas son
totalmente independientes unas de otras, de modo que no existe atracción
intermolecular alguna.
3. Las moléculas de un gas se
encuentran en movimiento continuo, en forma desordenada; chocan entre sí y
contra las paredes del recipiente, de modo que dan lugar a la presión del gas.
4. Los choques de las moléculas
son elásticos, no hay pérdida ni ganancia de energía cinética, aunque
puede existir transferencia de energía entre las moléculas que chocan.
5. La energía cinética media de
las moléculas es directamente proporcional a la temperatura absoluta del gas;
se considera nula en el cero absoluto.
OCTUBRE 6 DE 2012
PROYECTO: ESTILO DE VIDA SALUDABLE. PARA EL 16 DE OCTUBRE.
TEMA: VALORO MI CUERPO.
MATERIALES: gráficas que ilustren
las partes del cuerpo, rompecabezas con
la figura humana.
METODOLOGIA: dialogar sobre los
cuidados del cuerpo y sus posibles riesgos, inventar un cuento o una historia a
partir de las imágenes que se les presente, realizar
juegos con rompecabezas y observar láminas del esquema corporal: partes
externas e internas.
EL RESPETO Y CUIDADO DE MI CUERPO.
Una vida saludable no solo
implica el cuidado que los jóvenes deben tener a la hora de alimentarse o
llevar a cabo algún tipo de deporte, sino que también el respeto para su cuerpo
y la debida higiene que necesita para desarrollarse bien. Junto con la ducha
diaria y una adecuada limpieza de dientes, es preciso preocuparnos de nuestros
órganos sexuales. Esto es válido tanto para las damas como para los varones. El
cuerpo representa nuestra existencia en sí, por lo que debemos atesorarlo. Ello
considera estar alertas a cualquier anomalía que presente y acudir a un
especialista si ello así lo requiere. Hay que recordar que nuestro aparato
reproductor y, por ende, los genitales tienen un carácter de privacidad y deben
ser respetados. Este concepto se aplica en todas las culturas del mundo, desde
las más antiguas hasta las más modernas. ¿Y por qué alrededor de este tema
existe el concepto de privacidad? Porque el aparato reproductor -en ambos
sexos- se guarda y cuida como un tesoro debido a que es muy sensible y
representa la base de la multiplicación de la especie; de la reproducción
humana, de la población y de nuestras futuras generaciones, y no porque sea
algo ”feo“, ”sucio“ o ”pecaminoso“. Asimismo, no cualquier persona puede ver o
tocar nuestro cuerpo. Cuando pequeños nuestros padres nos ven desnudos para
bañarnos o vestirnos, como también el pediatra para revisarnos. Cuando llega la
época de la pubertad nos duchamos solos y nos ponemos más pudorosos. Eso es
normal. Como también lo es compartir duchas después del deporte. Lo que no es
correcto es que un pariente, amigo y menos un extraño nos vea desnudos o nos
quiera tocar. Si ello ocurriera, debemos contarles a nuestros padres para que
intervengan
OCTUBRE 4 DE 2012
CONSULTA:
OBSERVA EL SIGUIENTE VÍDEO ENTRANDO AL LINK QUE APARECE A CONTINUACIÓN Y ESCRIBE UN COMENTARIO EN TU CUADERNO DE TRABAJO:
http://www.youtube.com/watch?v=IpElL_9q0QM
SEPTIEMBRE 27 DE 2012
TEMA: LA LEPTOSPIROSIS.
MATERIALES: ilustraciones que
expresen los focos de trasmisión de la enfermedad, hojas, colores, goma,
tijeras, recortes de revistas acerca del
tema.
METODOLOGIA: explicar a los
estudiantes de los grados 4º y 5º a qué
se refiere, cuales son los síntomas y como se puede prevenir esta enfermedad. Utilizando
afiches que los niños elaborarán con los recortes de las revistas. RECUERDE LA
MODALIDAD DEL GRUPO DE TRABAJO.
Leptospirosis
Es una
infección bacteriana grave y poco común que ocurre cuando las personas están
expuestas a ciertos ambientes.
Causas, incidencia y factores de riesgo.
La
leptospirosis es causada por la exposición a varios tipos de la bacteria Leptospira,
la cual se puede encontrar en los climas más cálidos, en aguas dulces que han
sido contaminadas por la orina de animales.
No se
propaga de una persona a otra, excepto en casos muy raros cuando se transmite a
través de la leche materna o de una madre a su feto.
Síntomas
Fiebre
repentina, músculos adoloridos, reticencia a moverse, rigidez en los músculos,
piernas, marcha rígida, escalofríos, debilidad, depresión, falta de apetito, sed
y orina incrementados, puede ser indicativo de falla renal crónica, progresando
en inhabilidad para orinar.
Prevención
Evite
áreas de aguas estancadas, especialmente en los climas tropicales. Si usted
está expuesto a un área de alto riego, el hecho de tomar doxiciclina o
amoxicilina puede disminuir su riesgo de desarrollar esta enfermedad.
SEPTIEMBRE 21 DE 2012
TEMA:
CONTAMINACION AMBIENTAL.
MATERIALES:
temperas, colores, hojas de block, títeres y utensilios que se puedan reciclar.
METODOLOGIA:
Explicar a los niños que a través de dibujos y expresiones de sensibilización
por el medio ambiente podemos tener un planeta mejor.
 Todos los seres humanos
debemos entender que en donde vivimos nuestro planeta Tierra debe ser cuidado y
protegido. Y no existe nada mejor que nosotros como adultos enseñemos a los
niños mediante la interacción con dibujos, cantos y todo material didáctico que podamos desde
pequeños enseñarles que nuestro hogar el medio ambiente hay que cuidarlo
siempre.
Todos los seres humanos
debemos entender que en donde vivimos nuestro planeta Tierra debe ser cuidado y
protegido. Y no existe nada mejor que nosotros como adultos enseñemos a los
niños mediante la interacción con dibujos, cantos y todo material didáctico que podamos desde
pequeños enseñarles que nuestro hogar el medio ambiente hay que cuidarlo
siempre.
Por eso para realizar una
actividad práctica les dejo a continuación distintos dibujos sobre el medio
ambiente para colorear y que puedan los niños pintar con temperas, acuarelas,
marcadores, lápices de colores y cualquier idea que pueda implementar en estos
dibujos con la temática del cuidado del medio ambiente.
SEPTIEMBRE 5 DE 2012
TEMA: EL VALOR DE LA
AMISTAD
LUGAR: JARDIN INFANIL
SAN LUIS
MATERIALES: juguetes,
balones (artículos que permitan ser intercambiados o prestados entre ellos). Recuerde
la modalidad del grupo al que pertenece.
La amistad.
La
amistad es uno de los valores más importantes a desarrollar en la educación de
los niños. Se trata del afecto personal, puro y desinteresado, compartido con
otra persona, que nace y se fortalece mediante las interrelaciones entre los
seres humanos.
Para
que el niño aprenda sobre el valor de la amistad es necesario formarle con
nociones, conocimientos, habilidades, emociones, vivencias, sentimientos, y que
le preparemos para vivir con armonía y respeto.
Aprender a ser amigo.
Los
niños deben saber quién es un buen amigo y por qué, cómo se comportan los
buenos amigos, y cómo mantener una buena amistad. Deben aprender que un buen
amigo puede ser para siempre, y que para eso es necesario cultivar y alimentar
la amistad, día tras día, en la escuela, en el parque, en la vecindad, etc. El
contacto con los iguales hace con que el universo del niño sea aún más
grandioso y rico. A través del otro, él puede aprender mucho de todo y de sí
mismo.
El niño puede aprender a
ser amigo:
- Busca la conciliación y no
se pelea con sus compañeros
- Comparte sus juguetes con
los demás niños
- Conversa y atiende a los
demás
- Ayuda a un compañero que ha
hecho algo malo explicándole lo incorrecto de su actuación
- Se preocupa por sus
compañeros
- Se esfuerza por hacer algo
útil en beneficio de los amigos
- Anima al compañero o amigo
que esté triste
- Se alegra con los logros
positivos de los demás
- Invita a sus amigos a jugar
en su casa
- Se preocupa por algún amigo
herido o enfermo
- Demuestra afecto y cariño a
sus amigos
Fuente consultada: - Cuentos y canciones para compartir valores. Ed. de
la Infancia

SEPTIEMBRE 3 DE 2012
ESTIMADOS ESTUDIANTES: las siguientes bibliografías y links le pueden ayudar a tener un mejor desempeño al momento de realizar los ejercicios de estequiometria. Visitálos.
http://www.eis.uva.es/~qgintro/esteq/esteq.html
http://www.profesorenlinea.cl/Quimica/Estequiometria.html
http://genesis.uag.mx/edmedia/material/quimicaII/estequiom.cfm
AGOSTO 23 DE 2012
PROYECTO VIDA SALUDABLE
TEMA:
El Aseo Personal
 Se
le llama aseo personal o higiene personal al acto,
generalmente autónomo, que un individuo realiza para mantenerse limpio y libre
de impurezas en su parte externa. En algunas personas, bien sea por algún tipo
de impedimento físico, se les dificulta. Para el aseo personal suelen usarse
productos químicos tales como jabón, aceites, cremas, champú,
entre otros. El aseo personal es muy recomendado por la ciencia médica. Ayuda a
prevenir infecciones y otras molestias, especialmente cutáneas.
Se
le llama aseo personal o higiene personal al acto,
generalmente autónomo, que un individuo realiza para mantenerse limpio y libre
de impurezas en su parte externa. En algunas personas, bien sea por algún tipo
de impedimento físico, se les dificulta. Para el aseo personal suelen usarse
productos químicos tales como jabón, aceites, cremas, champú,
entre otros. El aseo personal es muy recomendado por la ciencia médica. Ayuda a
prevenir infecciones y otras molestias, especialmente cutáneas.
Los hábitos de
aseo son muy importantes para nosotros ya que evitan que nos
enfermemos, por esta razón, tener una buena higiene afecta la salud y el
bienestar de
los
niños y de las personas con quienes estos pasan el día. Es importante
pasar más tiempo practicando y enseñando a
los
niños pequeños buenos hábitos de aseo personal en casa
y
en el centro de cuidados infantiles.
La mejor forma de que
los
niños aprendan estas buenas costumbres es incluyéndolas
en
la rutina diaria.
Lavado
de manos: tener un
buen lavado de manos echo con frecuencia ,puede reducir enfermedades
y eliminar suciedad el riesgo de absorber toxinas como puede ser
el plomo. Lavarse las manos antes de comer y después de ir al baño
y también después de jugar al aire libre o de tocar a sus
mascotas.
Sonarse
la nariz ,toser y estornudar:enseñar
a los niños a toser , sonarse y estornudar para cuando uno quiere toser es
recomendable taparse con el ante brazo nunca con la mano por que al saludar
pasa todos los germenes , cunado uno quiere
estornudar también taparse con el ante brazo para no pasar los
germenes y al sonarse botar el papel a la caneca y no quedarse con el.
Pelo : tenerlo muy limpio lavarlo uno o dos
veces por semana y tenerlo cepillado.
Uñas
: es muy importante
tenerlas limpias las uñas bien presentadas limpias no muy largas ni tampoco muy
cortas y quitase el mugre que guarda hay en las uñas para
no meterse lo por la boca y poderse enfermar .
Juguetes
: los juguetes de los
niños tenerlos limpios por que aveces a los niños les da
por meterse-los a la boca y eso les puede dar una enfermedad entonces
por eso hay que tenerlos limpios .
Ropa
: Debe estar limpia y
ser cómoda y apropiada para la
temperatura
del entorno.
AGOSTO 8 DE 2012
CRONOGRAMA
PROYECTO DE ESTILOS DE VIDA SALUDABLES
DÉCIMO
FECHA
|
TEMA
|
LUGAR
|
RESPONSABLE
|
14 de Agosto
|
El Infarto
|
Liceo Mixto Santa María
|
Psicorientacion
|
21 de Agosto
|
Enfermedades
de transmisión sexual
|
Colegio La Esperanza
|
Psicorientacion
|
28 de Agosto
|
El aseo
personal
|
Jardín
Infantil San Luis
|
Docente
Lupercio Amaris
|
11 de Septiembre
|
Rumba-terapia
|
Casa
Tercera Edad Barrio 20 de Julio
|
Pastoral
|
18 de Septiembre
|
Artes, dibujos.
|
Liceo Mixto Santa María
|
Docente
Lupercio Amaris
|
25 de Septiembre
|
La Contaminación
ambiental
|
Colegio La Esperanza
|
Docente
Lupercio Amaris
|
2 de Octubre
|
La Leptospirosis
|
Liceo Mixto Santa María
|
Docente
Lupercio Amaris
|
16 de Octubre
|
Prevención
de Enfermedades del corazón
|
Casa
Tercera Edad Barrio 20 de Julio
|
Pastoral
|
23 de Octubre
|
Cuidado de
los dientes
|
Jardín
Infantil San Luis
|
Docente
Lupercio Amaris
|
30 de Octubre
|
La
Sexualidad
|
Colegio La Esperanza
|
Docente
Lupercio Amaris
|
13 de Noviembre
|
Clausura
del proyecto estilos de vida saludables
|
Colegio San
Alberto Magno
audiovisuales
|
Docentes
que intervinieron en la gestión
|
Cultivar el optimismo o El arte de ver el vaso medio lleno.
MATERIALES:
afiches o ilustraciones del corazón, algunas muestras de alimentos saludables,
premios (dulces o sorpresas).
METODOLOGIA: se
presentarán los temas a niños entre los 7 y 12 años que cursen de 3 grado a 5
grado. Explicarán el tema del infarto teniendo en cuenta la modalidad del grupo
al que pertenezca, es decir, DINAMICA, TEST, TEATRO Y NARRACION. De igual
manera la presente es para que puedan desarrollar y ampliar el tema. Pueden
consultar textos donde hablen del infarto.
El optimismo es sin
duda un estigma de la personalidad. Una clave que podría llegar a marcar la
diferencia entre ser felices o no serlo. Ser optimista implica darle mayor
valor a los aspectos positivos que a los negativos, en el instante en que se
está viviendo dicha situación. Por otra parte ser optimista implica una mayor
confianza en que los sucesos por venir serán favorables.
El optimismo no
supone tener una opinión simple de todo lo que nos rodea, sino dar la relevancia
justa a los aspectos positivos de las cosas. Esto no es necesariamente
conformarse pensando que las cosas podrían ser peores sino más bien enfatizar
los puntos ventajosos y prometedores de las situaciones vividas.
Liberarse de
sentimientos de culpabilidad o de todo aquello nos hace sentir solos o
infelices, desgraciados o indefensos, es un muy buen enfoque para llevar la
vida adelante. Descubrir alegría en la vivencia cotidiana, sin intentar
encontrar una felicidad completa y perfecta, es también una actitud optimista
que sin lugar a dudas genera importantes beneficios para la calidad de vida.
En este sentido,
aceptar el envejecimiento del cuerpo, puede ser el descubrimiento de nuevas
posibilidades y experiencias. En la vida, hay un momento para cada cosa, y cada
etapa tiene alguna ventaja que disfrutar.
En consecuencia, el
optimismo desemboca en actitudes tan positivas como el coraje, el entusiasmo,
la pasión, la confianza, la esperanza y el ver los errores como oportunidades
para aprender. Las personas optimistas tienden a ser más perseverantes, tener
mejor humor, ser más exitosos y a ver realizados sus proyectos en mayor medida
que las pesimistas.
En el ámbito de
la salud las personas
optimistas, además de sentirse más felices, gozan de mejor salud, porque su
sistema inmunológico es más fuerte, lo que se puede relacionar con una
produción mayor de endorfinas. El estado contrario, estados depresivos o de
ánimo bajo, podrían relacionarse con una propensión a contraer enfermedades.
También se ha
demostrado que ser optimista mejora la actividad neurológica en el cíngulo
anterior y en la amígdala (que son las áreas que funcionan mal en la depresión)
y favorece la actividad del sistema inmunológico. Además, las
estadísticas indican que el optimismo ayuda a prevenir las enfermedades
cardíacas y a afrontar mejor las enfermedades tumorales, y que los optimistas
viven alrededor de un 19% más que los pesimistas, lo que demuestra que la salud
no depende sólo de valores físicos, sino también de la actitud con la que las
personas enfrentan la vida.
Por lo tanto,
sáquese las penas de encima, disfrute la vida, aunque sea con limitaciones, eso
siempre será mejor que vivir bajo un manto de pena y pesimismo. Busque las
cosas buenas, disfrute de las cosas simples, no hay que ser millonario para ver
una hermosa flor en primavera y sentir el canto de los pájaros, tampoco para
disfrutar aunque sea de una simple taza de té con los amigos.
Dr. Christian Espinoza S.
Cardiocirujano
Cardiocirujano
AGOSTO 1 DE 2012
LEE EL SIGUIENTE ARTICULO Y ESCRIBE TU COMENTARIO:
El descubrimiento de la Partícula de Dios, también conocida como bosón de Higgs (en honor a Petter Higgs, quien propuso esta teoría hace 48 años), es un parte aguas en el mundo de la ciencia.
Fue dado a conocer el miércoles en medio del júbilo por parte de la Organización Europea para la Investigación Nuclear (Cern), en cuya sede de Suiza se hicieron los experimentos.
En términos prácticos, explica el físico Norberto Granda, director del Grupo de Gravitación del Departamento de Física de la Universidad del Valle, lo que se hizo fue llegar a la estructura más pequeña de la materia que haya sido posible hasta el momento. El experto explica los alcances del hallazgo.
¿Cuál es la importancia del descubrimiento de la Partícula de Dios?
Su importancia radica en que es el último ingrediente que faltaba para completar el Modelo Estándar, era la partícula más difícil de detectar y posiblemente, según los datos experimentales de Cern, ya se puede hablar con certeza de su existencia.
¿Qué es el Modelo Estándar?
Es la teoría física que explica la composición de las partículas elementales y las interacciones entre esas partículas elementales, exceptuando la interacción gravitacional.
¿Qué son las partículas elementales?
Por elementales se entiende que no tienen componentes, es decir, que no están hechas de otras estructuras. Estas se clasifican en dos grupos, leptones, que significan partículas livianas y que se agrupan en tres familias o generaciones (el leptón más conocido es el electrón). Y el segundo grupo se conoce como los quarks, que también se agrupan en tres generaciones. Estos dos tipos de partículas (los leptones y los quarks) son los componentes básicos de la materia. Es decir, cualquier tipo de materia debe estar constituida por leptones y por quarks.
¿Por qué se dice que este descubrimiento ayuda a entender el origen del Universo mismo?
La física no responde a la pregunta por qué, sino al cómo. Entonces la importancia del bosón de Higgs (Partícula de Dios), es que tuvo que haber existido en una etapa muy temprana del universo.
Básicamente lo que se reproduce en estos laboratorios son las condiciones en esas etapas muy tempranas del Universo que dieron lugar precisamente a que más tarde la alta simetría que existía en ese Universo temprano se rompiera, dando lugar a que muchas de las partícu las adquirieran masa.
Lo que se hace en estos experimentos es tratar de entender cómo era el Universo en eras muy tempranas y por edad muy temprana estoy hablando de 10 a la -33 segundos después del Big Bang, que es la era de la gran unificación. El rompimiento espontáneo de la simetría, en el que aparece el bosón de Higgs, se desata unos 10 a la -33 segundos después del Big Bang. Entonces digamos que este descubrimiento al menos nos acerca mucho a una de las explicaciones más populares y tal vez la más sencilla sobre cómo surgieron las masas de las partículas elementales.
¿Cómo es ese experimento que se realiza en el acelerador de partículas más grande del mundo, situado en la sede de Cern, en Ginebra (Suiza)?
Allí lo que se hace es chocar haces de protones con antiprotones, que son partículas pesadas, y las aceleran a una velocidad muy cercana a la de la luz. De ahí que el anillo de este laboratorio tenga una circunferencia de 27 kilómetros. Estos protones hacen varios giros alrededor de este anillo, controlados por fuertes campos magnéticos para que se mantengan bien alineados y por una trayectoria paralela se hacen correr antiprotones, que giran en sentido contrario. Lo que hacen es que instalan detectores en ciertas partes del túnel donde hacen chocar los haces de protones con los de antiprotones y se genera una enorme cantidad de partículas. De esta manera se puede mirar más al interior de la materia, en la medida en que los potentes equipos de cómputo puedan leer la enorme cantidad de datos que se generan. Es algo así como cuando usted coge una taza, la rompe y queda en pedazos, rompiendo estos pedazos cada vez más va a llegar a estructuras más pequeñas de lo que compone la taza. El hecho de romper es ir invirtiendo energía. Y para romper en trozos cada vez más pequeños se necesita, a su vez, más energía. Eso significa que a medida que dispongamos cada vez más energía podremos escudriñar cada vez más al interior de la estructura de la materia. Esto es lo que se pretende con estas grandes máquinas, como los aceleradores de partículas.
Es decir, ¿se llegó a la mínima expresión de la materia?
Se ha logrado investigar la estructura de la materia a las distancias más pequeñas posibles que se puedan estudiar actualmente. Lo que se está haciendo es bucear cada vez más adentro de la materia.
¿Qué utilidades para el hombre tiene este descubrimiento, en términos prácticos?
Es motivo de orgullo que una teoría que llevaba 48 años de ser propuesta (la Partícula de Higgs se propuso en el año 1964), haya sido finalmente detectada.
Inclusive se creyó que la teoría física que estaba detrás había que descartarla, estábamos en una situación de poca esperanza de hallarla y se estaban buscando alternativas.
Es un triunfo del pensamiento y de la capacidad del hombre de que sus teorías encuentren un soporte experimental. Detrás de toda esta parafernalia instrumental hay mucha tecnología colateral que se desarrolla, que después se implementa en todos los equipos que para nosotros son conocidos. En estos grandes experimentos se implementan muchas nuevas tecnologías que encuentran después aplicaciones prácticas que mejoran nuestra calidad de vida. Nada más el hecho de crear detectores con una alta capacidad de lectura de datos, hace que más tarde se puedan transmitir todos estos conocimientos a aplicaciones tecnológicas que estén al alcance de todos. Estas nuevas tecnologías nos hacen llegar cada vez más lejos.
¿Cuál es la tarea que sigue para los científicos que están detrás de este hallazgo?
Tienen que seguir afinando los experimentos, seguramente ellos, al tener acorralado el intervalo de masa donde pueda estar la partícula de Higgs, tienen más certeza de dónde localizarla.
Lo que se va a venir es la toma de muchos más datos experimentales para tener cada vez más certeza de la masa exacta de esa partícula.
Creo que lo resta del año y comienzos del entrante se van a seguir consiguiendo más datos que den una total certeza sobre la existencia del Higgs.
Como experto en la materia, ¿cómo califica y cómo siente este hallazgo?
Las personas que conocen el tema saben que es un descubrimiento fundamental y va a marcar un hito, un antes y un después. Es, sin duda, un salto enorme para la ciencia.
JULIO 25 DE 2012
COMPROMISO: PARA QUE RESUELVAS EN TU CUADERNO DE TRABAJO
JULIO 14 DE 2012.
RESUELVE EN EL CUADERNO DE ACTIVIDADES.
1.Completa la tabla con otras situaciones de la naturaleza y del entorno en general que involucren cambios físicos y químicos. Luego, clasifica y justifica el cambio.
SITUACION
|
CAMBIO FISICO
|
CAMBIO QUIMICO
|
ARGUMENTACION
|
Doblar un alambre
|
x
|
El alambre mantiene sus características químicas
| |
Descomposición de un trozo de carne
| |||
La gasolina arde
| |||
Piedra triturada
| |||
Agua disuelta en sal
|
<!--[if !supportLists]-->1.
<!--[if !supportLists]-->2. 2. <!--[endif]-->Representa las sustancias de cada cambio químico anterior en una ecuación como la siguiente:
Reactante 1 + reactante 2 ---------------- productos
<!--[if !supportLists]-->3. 3. <!--[endif]-->Manuela y Camila son jóvenes que asisten a la escuela rural. Un día dialogan acerca de lo que sucede cuando sus padres preparan los abonos o fertilizantes para los cultivos.
Manuel: cuando mi papá adiciona el abono al agua, esta cambia de color y se siente un olor desagradable, aun con poca cantidad de abono.
Camila: Manuel, los abonos no generan una reacción al entrar en contacto con el agua. Probablemente, el cambio de color se debe a la cantidad de abono que se agrega. Yo pienso que el agua solo disuelve el abono.
El profesor de química que los escucha atentamente decide participar en la conversación. ¿A quién le dará la razón el profesor? Justifica tu respuesta.
JUNIO 6 DE 2012
ACTIVIDAD EN CASA
 Observa atentamente el siguiente vídeo en http://youtu.be/2ixg7fZ1IL4 y anota los datos más importantes sobre su nomenclatura.
Observa atentamente el siguiente vídeo en http://youtu.be/2ixg7fZ1IL4 y anota los datos más importantes sobre su nomenclatura.MAYO 30 DE 2012
PARA QUE TENGAS EN CUENTA: Nomenclatura de Hidróxidos
Que son los Hidróxidos? Son los compuestos que se forman por la reacción de un oxido básico con el agua. La fórmula general es:
M(OH)x (siendo x el número de oxidación del metal)El grupo hidroxilo (OH) siempre tiene número de oxidación -1.
Ejemplos:
NaOH
hidróxido sódico o de sodio
Pb(OH)2
dihidróxido de plomo
hidróxido de plomo(II)
hidróxido plumboso
Fe(OH)3trihidróxido de hierro
hidróxido de hierro (III)
hidróxido férrico
Fe(OH)2
dihidróxido de hierro
hidróxido de hierro (II)
hidróxido ferroso
NaOH
hidróxido sódico o de sodio
Pb(OH)2
dihidróxido de plomo
hidróxido de plomo(II)
hidróxido plumboso
Fe(OH)3trihidróxido de hierro
hidróxido de hierro (III)
hidróxido férrico
Fe(OH)2
dihidróxido de hierro
hidróxido de hierro (II)
hidróxido ferroso
Visita el siguiente link: http://www.bioygeo.info/Animaciones/Peroxidos.swf
ABRIL 12 DE 2012
COMPROMISO
Realiza los siguientes ejercicios en tu cuaderno de trabajo:
Ejercicios:
- Escribe la configuración electrónica del Radio (Z = 88). ¿Cuáles son los electrones de interés en química?
- Escribe la configuración electrónica del 74W. ¿Cuáles son los electrones de interés en química?
- Escribe la configuración electrónica del 94Pu. ¿Cuáles son los electrones de interés en química?
- Escribe la configuración electrónica del 52Te2-. ¿Cuáles son los electrones de interés en química?
- Escribe la configuración electrónica del 78Pt2+. ¿Cuáles son los electrones de interés en química?
MARZO 16 DE 2012
OBSERVA EL SIGUIENTE VÍDEO Y COMENTA:
TEMAS DE EXPOSICIONES:
Para sustentar el día 21 de Marzo en grupo de tres estudiantes, debe consultar en qué grupo quedó ubicado el estudiante que se encuentra de viaje en Bogotá.
- Normas del Laboratorio (Serrato)
- Materiales Volumétricos (Maldonado)
- Materiales Graduados (Alcendra)
- Etiquetas en los Envases (Pérez-Pinilla)
- Instrumentos de Soporte (Ospino)
- Manejo y uso de Logaritmos (De La Rosa)
- Iones Poliatómicos Comunes( Rada)
- Otros Elementos del Laboratorio (Bernal)
- Äreas de la Química (Bohorquéz)
- Métodos de Separación (Salazar- Miranda)
















.jpg)





























este fenomeno anterior fue descubierto por LUIGI GALVANI un médico y fisiologo que había descubierto esto mientras disecaba una pata de rana, su bisturí tocó accidentalmente un gancho de bronce del que colgaba la pata,ne el cual se produjo una descarga, y la pata se contrajo Mediante repetidos y consecuentes experimentos, Galvani se convenció de que lo que se veía eran los resultados de lo que llamó electricidad animal. apartir de esto podemos concluir que el bronce es un elemento muy bueno al transferir electricidad los fisicos alejandro volta y maicol faraday dan aportes y se dan las leyes de la electrolisis.
ResponderEliminareste experimeto que descubrio galvani se debe a la energia que hay en la rana debido a esto se produce con la regillade los cables de cobre reciben una descarga las ancas de la rana se mueven gracias a esto
ResponderEliminarEn el vídeo se muestra las reacciones de una rana al entrar en contacto con la energía producida por una pila conectada a los cables.
ResponderEliminarAquí se demuestra que un cuerpo posee energía propia, como lo expresó Luigi Galvani cuando accidentalmente hizo que unas ancas de rana que se encontraban en una reja de hierro se encogieran espontáneamente al tocarlas con un alambre de cobre.
En el vídeo se demuestra la teoría de Galvani muy bien.
En el video se muestra que al unir la pila con el generador eléctrico se produce un movimiento en la rana debido a la electricidad que poseen los seres vivos según el fisiólogo louigi galvanni, quien descubrió esto accidentalmente en el año 1786
ResponderEliminarMauricio Jose Maldonado Iturriago
ResponderEliminareste fenomeno fue inventado por luigy galvany
en este video se muestra que al unir la pila con la energia y colocarla sobre el anca de la rana es decir la parte posterio esta se les mueven las patas esto fue descubierto en el año de 1786
EDGAR AYALA GOMEZ 10
ResponderEliminaren el vídeo podemos ver unos de los experimentos de el físico (luigi galvani) para esto se necesita un rana, una pila y un generador eléctrico. en esto podemos ver que el generador eléctrico hace q la rana produzca saltos o convulsiones lentas pero se puede llegar a observar el cambio en la rana.
Luis manuel viloria I.
ResponderEliminarLuigi galvani se relaciono con la electricidad, en La decada de los años setenta supuso para el el interes por la fisiología del sistema nervioso y muscular.
En 1772 presento una comunicacion a un instituto sobre la irritabilidad halleriana y poco despues sobre los movimientos musculares de las patas de la rana (como muestra en el video anterior, que las patas de rana conducen electricidad generando repentinos movimientos y produciendo una descarga electrica sobre el cuerpo de este). En 1774 leyó un artículo sobre el efecto de los opiáceos en los nervios de las ranas. Esto le llevó a investigar la estimulación de nervios y músculos en estos animales.
en el vídeo podemos observar como las ranas por dentro pueden producir electricidad esto fue descubierto por luigi galvani usando una pila y un generador de electricidad logro demostrar que las ranas pueden dar pequeños movimientos cuando se le acerca un poco de electricidad
ResponderEliminaratt: jorge aldana
A fines del siglo XVIII, el médico y físico italiano Luigi Galvani registró por primera vez el fenómeno de la contracción de un músculo de cadáver mientras disecaba una rana en una mesa donde había realizado experimentos con electricidad. Galvani acuñó el término electricidad animal para denominarlo, mientras que actualmente se denomina galvanismo. Galvani y sus contemporáneos consideraron que la activación muscular era resultado de un fluido eléctrico o sustancia presente en el nervio.
ResponderEliminarEn el vídeo podemos ver que Luigi Galvani se relaciono con la electricidad en la epoca de los años 70 supuso para el, el interés por la fisiología del sistema nervioso y muscular .... por eso poedemos observa como las ranas por dentro pueden producir electricidad, acompañado de una pila y un generador de electricidad... se puede ver que la rana puede dar pequeños movimientos cuando se le acerca un poko de electricidad..
ResponderEliminarbueno lo que podemos observar en este vídeo es la teoría de luigi galvani la cual estos muchachos con una rana una pila y unos alambres hacen que la rana se mueve o viva con la electricidad, esto también lo podemos observar en nuestros días cuando se utiliza para los electrochoque para las personas para que reaccione o para salvar su vida, esta teoría la descubrió luigi ya que cuando disecaba una rana la pata de la rana toco el bisturí y al tener contacto con ella se produjo un movimiento en la rana repetidamente y el desde allí saco su teoría que la llamo electricidad animal...
ResponderEliminarATT: SHARON PAOLA LLANOS OROZCO 10
en este video se puede observar que la energia es una magnitud muy importante tanto para el desarrollo quimico,biologico y fisico...
ResponderEliminaresto se deve a que los seres vivos dependen de la energia electrica.....
esto se deve gracias al descubrimiento de el fisiólogo louigi galvanni, quien descubrió esto accidentalmente en el año 1786.
en este video nos muestran como por accidente el El médico galvanni había descubierto este fenómeno mientras disecaba una pata de rana, su bisturí tocó accidentalmente un gancho de bronce del que colgaba la pata. Se produjo una pequeña descarga, y la pata se contrajo espontáneamente.
ResponderEliminaren este video se hace el experimento con una pequeña rana, un pila, unos cables y gracias a un generador la electricidad pasa de la pila a la rana generando pequeñas descargas
el fenomeno fue inventado por liugi galvanni mientras disecaba una pata de rana, necesito una pila y uun generador electrico para q funcionara, y ademas el cuerpo posee su propia energi a
ResponderEliminarEn este video observamos lo que pasa cuando la electricidad entra en contacto con los musculos y el sistema nervioso de una rana ya que el sistama nervioso usa señales nerviosas para poder producir el movimiento
ResponderEliminarJuan almanza 10º
en este video obserbamos que los muchachos o los medicos en la actulidad lo utilizan cuando hay paros cardiacos pero ellos lo hicieron para que la rana moviera sus partes por medio de la electricidad que corre por los nervios
ResponderEliminarEn este video se puede analizar como Galvani experimenta sobre el efecto de la electricidad en la movilidad muscular, donde expuso la teoría de la existencia de una fuerza vital de naturaleza eléctrica que regiría los sistemas nervioso y muscular. Att: Luiisa Vergara
ResponderEliminarESTE VIDEO SE TRATA DE: interpretarlo como el fenómeno, debido a un estímulo externo provocado por la chispa que a través de el incidía en el nervio de la rana y se descargaba sobre el músculo.
ResponderEliminarJóvenes que experimentan las ideas de Galvani
El fenómeno fue inventado por liugi galvanni en este video observo que él toma la rana una pila con la energía la coló en la rana y eso hace que el sistema nervioso la rana produzca movimiento.
ResponderEliminaren este video podemos observar el fenomeno ke fue creado por luigi galvani ..... como la rana recibe las cargas electricas por medio de dos cables de cobre que es el que permite su movilidad att: estefania pinilla
ResponderEliminarEn este video se peuede observar que los jovenes (Galvani) Actualmente hicieron experimentos con la electricidad lo cual permite saber que las ancas chocaron y cojen impulsos nerviosos. Att: Karla perez
ResponderEliminar