NOVIEMBRE 5 DE 2014
LINK PARA OBSERVAR VIDEO: Pelicula completa: El Experimento.
https://www.youtube.com/watch?v=6UOWGiVl9TE#action=share
AGOSTO 1 DE 2014
OBSERVA Y REDACTA UN RESUMEN EN TU CUADERNO SOBRE LO QUE COMPRENDISTE:
JULIO 21 DE 2014
COMPROMISO DE QUÍMICA
ESCRIBE EN TU CUADERNO Y ESTUDIA
Indique el período, grupo y tipo de elemento para los átomos que tienen la siguientes configuraciones electrónicas :
a) 3s2 3p5
Configuracíón electrónica externa : 3s2 3p5
Configuración electrónica estándar : 1s2 2s2 2p6 3s2 3p5
Configuración electrónica condensada: [Ne]3s2 3p5
Para conocer el período consideramos los electrones de valencia que se ubican en el nivel más alejado del núcleo. Esto es n=3, por lo tanto decimos que el período =3.
Los elementos con configuración electrónica externa del tipo s2 p5 corresponden al grupo VIIB.
Los elementos del grupo VIIB son del tipo Halógenos.
Sumando todos los electrones obtenemos su número atómico, por lo tanto decimos que Z=17.
Conclusión : el elemento con configuración electrónica 3s2 3p5 es el CLORO.
b) 3s2 3p6 3d5 4s2
Configuración electrónica externa : 4s2
Configuración electrónica estándar : 1s2 2s2 2p6 3s2 3p6 4s2 3d5
Configuración electrónica condensada: [Ar]3d5 4s2
Para conocer el período consideramos los electrones de valencia que se ubican en el nivel más alejado del núcleo. La configuración electrónica externa es 4s2, esto es n=4, por lo tanto decimos que el período = 4.
Elementos con configuración electrónica externa del tipo 3d5 4s2 son del tipo metal de transición.
Para los elementos de transición se deben sumar los electrones del nivel más alto (n=4) con los electrones de los orbitales d inmediatamente anteriores , por ser los orbitales 3d de mayor energía que los orbitales 4s (Ver *). Con esta suma de electrones se obtiene directamente el grupo.
Por lo tanto : 2 e- (4s) + 5 e- (3d) = 7 e- ubicados en orbitales de distinto nivel energético.
Así el elemento pertenece al grupo VII A, es un elemento de transición.
Sumando todos los electrones obtenemos su número atómico, por lo tanto decimos que Z= 25.
Conclusión: el elemento con configuración electrónica 3s2 3p6 3d5 4s2 es el MANGANESO.
c) 3s2 3p6 4s2
Configuración electrónica externa: 4s2
Configuración electrónica estándar: 1s2 2s2 2p6 3s2 2p6 4s2
Configuración electrónica condensada: [Ar] 4s2
Para conocer el período consideramos los electrones de valencia que se ubican en el nivel más alejado del núcleo. La configuración electrónica externa es 4s2 , esto es n=4, por lo que decimos que el periodo =4.
Elementos con configuración electrónica externa del tipo s2, corresponden al grupo IIA.
Los elementos del grupo IIA son del tipo Alcalinos Terreos.
Sumando todos los electrones obtenemos su número atómico , por lo tanto decimos que Z=20-
Conclusión: el elemento con configuración electrónica 3s2 3p6 4s2 es el CALCIO.
JUNIO 9 DE 2014
OBSERVA ATENTAMENTE Y ESCRIBE UNA CONCLUSIÓN:
ABRIL 8 DE 2014
MARZO 31 DE 2014
MARZO 19 DE 2014
TEMAS PARA CONSULTAR:
A continuación puedes visitar los links relacionados para preparar tu exposición:
http://www.areaciencias.com/compuestos-quimicos.htm
https://sites.google.com/site/laquimicaennuestroentorno/elementos-quimicos-basicos-en-los-seres-vivos
MARZO 10 DE 2014
LINK PARA OBSERVAR VIDEO: Pelicula completa: El Experimento.
https://www.youtube.com/watch?v=6UOWGiVl9TE#action=share
AGOSTO 1 DE 2014
OBSERVA Y REDACTA UN RESUMEN EN TU CUADERNO SOBRE LO QUE COMPRENDISTE:
JULIO 21 DE 2014
COMPROMISO DE QUÍMICA
ESCRIBE EN TU CUADERNO Y ESTUDIA
Indique el período, grupo y tipo de elemento para los átomos que tienen la siguientes configuraciones electrónicas :
a) 3s2 3p5
Configuracíón electrónica externa : 3s2 3p5
Configuración electrónica estándar : 1s2 2s2 2p6 3s2 3p5
Configuración electrónica condensada: [Ne]3s2 3p5
Para conocer el período consideramos los electrones de valencia que se ubican en el nivel más alejado del núcleo. Esto es n=3, por lo tanto decimos que el período =3.
Los elementos con configuración electrónica externa del tipo s2 p5 corresponden al grupo VIIB.
Los elementos del grupo VIIB son del tipo Halógenos.
Sumando todos los electrones obtenemos su número atómico, por lo tanto decimos que Z=17.
Conclusión : el elemento con configuración electrónica 3s2 3p5 es el CLORO.
b) 3s2 3p6 3d5 4s2
Configuración electrónica externa : 4s2
Configuración electrónica estándar : 1s2 2s2 2p6 3s2 3p6 4s2 3d5
Configuración electrónica condensada: [Ar]3d5 4s2
Para conocer el período consideramos los electrones de valencia que se ubican en el nivel más alejado del núcleo. La configuración electrónica externa es 4s2, esto es n=4, por lo tanto decimos que el período = 4.
Elementos con configuración electrónica externa del tipo 3d5 4s2 son del tipo metal de transición.
Para los elementos de transición se deben sumar los electrones del nivel más alto (n=4) con los electrones de los orbitales d inmediatamente anteriores , por ser los orbitales 3d de mayor energía que los orbitales 4s (Ver *). Con esta suma de electrones se obtiene directamente el grupo.
Por lo tanto : 2 e- (4s) + 5 e- (3d) = 7 e- ubicados en orbitales de distinto nivel energético.
Así el elemento pertenece al grupo VII A, es un elemento de transición.
Sumando todos los electrones obtenemos su número atómico, por lo tanto decimos que Z= 25.
Conclusión: el elemento con configuración electrónica 3s2 3p6 3d5 4s2 es el MANGANESO.
c) 3s2 3p6 4s2
Configuración electrónica externa: 4s2
Configuración electrónica estándar: 1s2 2s2 2p6 3s2 2p6 4s2
Configuración electrónica condensada: [Ar] 4s2
Para conocer el período consideramos los electrones de valencia que se ubican en el nivel más alejado del núcleo. La configuración electrónica externa es 4s2 , esto es n=4, por lo que decimos que el periodo =4.
Elementos con configuración electrónica externa del tipo s2, corresponden al grupo IIA.
Los elementos del grupo IIA son del tipo Alcalinos Terreos.
Sumando todos los electrones obtenemos su número atómico , por lo tanto decimos que Z=20-
Conclusión: el elemento con configuración electrónica 3s2 3p6 4s2 es el CALCIO.
JUNIO 9 DE 2014
OBSERVA ATENTAMENTE Y ESCRIBE UNA CONCLUSIÓN:
ABRIL 8 DE 2014
MARZO 31 DE 2014
ESCRIBE EL SIGUIENTE PÁRRAFO EN TU CUADERNO DE TRABAJO Y ESTÚDIALO PARA LA PRÓXIMA CLASE:
La materia es todo lo que ocupa un lugar en el universo. Es todo aquello que se forma a partir de átomos o moléculas, con la propiedad de estar en estado sólido, líquido o gaseoso. Son ejemplos de materia las piedras, la madera, los huesos, el plástico, el vidrio, el aire y el agua. Al observar un paisaje pueden verse pájaros, árboles, un río, un caballo pastoreando, flores, etc. Todas esas cosas forman parte de la naturaleza y se pueden ver y tocar. Esa característica común (visible y palpable) que tienen todos los objetos se denomina materia. Es decir, la materia es lo que forman las cosas que tocamos y vemos.
La materia tiene volumen porque ocupa un lugar en el espacio. Además tiene masa, que es la cantidad de materia que posee un objeto y que se puede medir con una balanza. La materia, a diferencia de los objetos o cuerpos, no está limitada por la forma ni por el tamaño. A su vez, los objetos o cuerpos (por ejemplo una caja) pueden estar construidos por diferentes materiales (cartón, metal, madera, plástico). Además, un mismo objeto puede estar formado por uno o varios materiales (caja de madera con tapa de plástico y cerradura de metal). También, diferentes objetos pueden estar fabricados con el mismo tipo de material (balde, pelota y botella de plástico).En el universo, la materia suele encontrarse en tres estados diferentes de agregación: sólido (hierro, madera), líquido (agua de mar) y gaseoso (aire atmosférico). En estos tres estados de agregación se observan las siguientes características:
1) La materia está formada por pequeñas partículas.
2) Esas partículas están en constante movimiento (en los gases más que en los líquidos y sólidos).
3) Hay fuerzas de atracción entre las partículas que forman la materia (en los sólidos más que en líquidos y gases).
Esas partículas, que son pequeñísimas y que forman parte de la materia se denominan átomos.
ÁTOMO
Un átomo es la menor cantidad de un elemento químico que tiene existencia propia, y que no es posible dividir mediante procesos químicos. Un átomo es tan pequeño que una sola gota de agua contiene más de mil trillones de átomos. Los átomos están formados por un núcleo que contiene dos tipos de partículas: los protones (tienen carga eléctrica positiva) y los neutrones (sin carga eléctrica). Ambas partículas tienen una masa similar. Alrededor del núcleo se encuentran los electrones, que tienen carga eléctrica negativa y una masa muchísimo más pequeña que la correspondiente a los protones y neutrones. El átomo es eléctricamente neutro, ya que tiene tantos electrones como protones hay dentro del núcleo. Los electrones giran alrededor del núcleo en zonas llamadas orbitales, que se agrupan en niveles de energía. Los electrones que giran más cercanos al núcleo del átomo tienen menor energía que aquellos que lo hacen alejados del núcleo. Los electrones van llenando los orbitales desde la zona más cercana al núcleo hacia la más alejada. De esa forma, el último nivel que contenga electrones puede estar completo o incompleto.
Cuando el último nivel orbital está incompleto, el átomo es inestable y tiende a completarlo para ganar estabilidad. Para ello puede dar, recibir o compartir electrones con otros átomos. Es así como se forman agrupaciones de dos o más átomos. Un átomo puede prestarle a otro átomo uno o varios electrones. De esa forma ambos adquieren carga eléctrica. El átomo que gana electrones (queda cargado negativamente) se denomina anión. El átomo que pierde electrones (queda cargado positivamente) se llama catión. Tanto el anión como el catión reciben el nombre de "iones". Es decir, un ion es un átomo cargado eléctricamente, sea en forma positiva o negativa.
MARZO 19 DE 2014
TEMAS PARA CONSULTAR:
A continuación puedes visitar los links relacionados para preparar tu exposición:
http://www.areaciencias.com/compuestos-quimicos.htm
https://sites.google.com/site/laquimicaennuestroentorno/elementos-quimicos-basicos-en-los-seres-vivos
MARZO 10 DE 2014
QUÍMICA
1. OBSERVA EL SIGUIENTE VÍDEO Y ESCRIBE UN RESUMEN EN TU CUADERNO DE TRABAJO:
2. RECUERDA PREPARAR UNA EXPLICACIÓN POR FILAS ACERCA DE LOS APORTES REALIZADOS A LA QUÍMICA DE ALBERTO MAGNO. OBSERVA.
FEBRERO 10 DE 2014
LA QUÍMICA COMO CIENCIA
El filósofo griego Aristóteles pensaba que las sustancias estaba formada por cuatros elementos: tierra, aire, agua y fuego. Paralelamente discurría otra corriente paralela, el atomismo, que postulaba que la materia estaba formada de átomos, partículas indivisibles que se podían considerar la unidad mínima de materia. Esta teoría, propuesta por el filósofo griego Demócrito de Abdera no fue popular en la cultura occidental dado el peso de las obras de Aristóteles en Europa. Sin embargo tenía seguidores (entre ellos Lucrecio) y la idéa se quedó presente hasta el principio de la edad moderna.
Entre los siglos III a.C. y el siglo XVI d.C la química estaba dominada por la alquimia. El objetivo de investigación más conocido de la alquimia era la búsqueda de la piedra filosofal un método hipotético capaz de transformar los metales en oro. En la investigación alquímica se desarrollaron nuevos productos químicos y métodos para la separación de elementos químicos. De este modo se fueron asentando los pilares básicos para el desarrollo de una futura química experimental.
La Historia de la Química puede dividirse en 4 grandes épocas:
1.- La antigüedad, que termina en el siglo III a.C. Se producían algunos metales a partir de sus minerales (hierro, cobre, estaño). Los griegos creían que las sustancias estaba formada por los cuatros elementos: tierra, aire, agua y fuego. El atomismo postulaba que la materia estaba formada de átomos. Teoría del filósofo griego Demócrito de Abdera. Se conocían algunos tintes naturales y en China se conocía la pólvora.
2.- La alquimia, entre los siglos III a.C. y el siglo XVI d.C Se buscaba la piedra filosofal para transformar metales en oro. Se desarrollaron nuevos productos químicos y se utilizaban en la práctica, sobre todo en los países árabes Aunque los alquimistas estuvieron equivocados en sus procedimientos para convertir por medios químicos el plomo en oro, diseñaron algunos aparatos para sus pruebas, siendo los primeros en realizar una "Química Experimental".
3.- La transición, entre los siglos XVI y XVII Se estudiaron los gases para establecer formas de medición que fueran más precisas. El concepto de elemento como una sustancia que no podía decomponerse en otras. La teoría del flogisto para explicar la combustión.
4.- Los tiempos modernos que se inician en el siglo XVIII cuando adquiere las características de una ciencia experimental. Se desarrollan métodos de medición cuidadosos que permiten un mejor conocimiento de algunos fenómenos, como el de la combustión de la materia.
FEBRERO 7 DE 2014
Con toda nuestra ilusión, les doy la bienvenida a este primer ciclo de estudio secundario: soy la profesora Divina Luz Púa Villa.
A través de este punto de encuentro compartiremos todo tipo de recursos que favorezcan los aprendizajes de ustedes, tanto de primaria como la secundaria.
Espero que este sea un espacio que disfruten como alumnos, sus padres y madres.
¡Así que pasen, vean y disfruten! La puerta está siempre abierta.
NOVIEMBRE 18 DE 2013
RECUERDEN DESCANSAR Y REPASAR LOS CONTENIDOS PARA ESTAR PILOSOS EL PRÓXIMO AÑO.
OCTUBRE 16 DE 2013
Colombia en el año de la energía sostenible
El concepto “Energía Renovable” o “Energía de Fuentes Renovables”, hace referencia a aquella obtenida de recursos naturales que se renuevan o regeneran a través de ciclos biológicos, geológicos, físicos o químicos naturalmente en la tierra, y en períodos cortos o de mediano plazo, como por ejemplo, el ciclo del agua, el ciclo de vida de los árboles, la radiación proveniente del sol y las corrientes de viento. “Energía Limpia” implica que en su proceso de generación no se produce contaminación, o esta es mínima, como por ejemplo la energía eólica o la solar, las cuales no tienen emisiones gaseosas directas, ni causan daño ambiental en la obtención de los recursos fuente: viento y radiación solar, respectivamente.
una de las fuentes de energía más utilizada para operaciones industriales, el sector agropecuario, procesos de transporte y producción de servicios, son los combustibles derivados del petróleo como el Acpm y la gasolina, y otros combustibles fósiles como el gas natural y el carbón mineral, las cuales no son fuentes de energías renovables; además generalmente no son energías limpias, pues esto depende de la tecnología que se utilice para la combustión. El gas natural es especial porque aunque proviene de una fuente no renovable, es una energía limpia pues cuando se quema no genera contaminación por material particulado, cenizas, ni residuos.
Colombia no es ajena a las iniciativas de promoción e implementación de energías sostenibles.
SEPTIEMBRE 18 DE 2013
JULIO 10 DE 2013
El aparato circulatorio o sistema circulatorio es la estructura anatómica compuesta por el sistema cardiovascular que conduce y hace circular la sangre, y por el sistema linfático que conduce la linfa unidireccionalmente hacia el corazón. En el ser humano, el sistema cardiovascular está formado por el corazón, los vasos sanguíneos (arterias,venas y capilares) y la sangre, y el sistema linfático que está compuesto por los vasos linfáticos, los ganglios, los órganos linfáticos (el bazo y el timo), la médula ósea y los tejidos linfáticos (como la amígdala y las placas de Peyer) y la linfa.
La sangre es un tipo de tejido conjuntivo fluido y especializado, con una matriz coloidal líquida, una constitución compleja y de un color rojo característico. Tiene una fase sólida (elementos formes, que incluye a los leucocitos (o glóbulos blancos), los eritrocitos (o glóbulos rojos) , las plaquetas y una fase líquida, representada por el plasma sanguíneo.
JUNIO 13 DE 2013
NOTAS DE QUÌMICA SEGUNDO PERIODO FUERON PUBLICADAS EN ESTA FECHA
JUNIO 11 DE 2013
NOTA: SE REALIZÒ LA PUBLICACIÒN DE NOTAS DE BIOLOGÌA SEGUNDO PERIODO
JUNIO 7 DE 2013
CINE FORO
El día 6 de junio se llevó a cabo el cine-foro con motivo del Día Internacional del Medio Ambiente, por lo tanto desarrolla las siguientes preguntas en tu cuaderno de trabajo:
¿A qué se deben los Maremotos o Tsunamits?
¿En qué ciudades o paises se presentó?
¿Cuántas personas aproximadamente perecieron?
Realiza un mapa y delimita en qué zonas se han presentado hasta este momento.
¿Qué opinión tienes de la actividad?
NOTA: les hago una invitación especial a mis estudiantes que se dediquen a comprometerse con sus actividades, tomar en serio cada una de las indicaciones y venir con ánimo para el nuevo semestre, además, felicito aquellos jóvenes que han alcanzado los logros , continúen así.
PARA TODOS UNAS FELICES VACACIONES
MAYO 28 DE 2013
CURIOSIDADES DE LAS PLANTAS
Muchas de las sustancias de desecho son utilizadas por el hombre de forma industrial. Por ejemplo el chicle, que es un polimero gomoso, dulce y aromático que forma la goma de mascar. Ya era utilizado por los indígenas de Centroamérica como dulce.
Otra sustancia utilizada por el hombre es el látex, obtenido del árbol Hevea brasiliensis que se conoce como caucho natural. El látex se ha utilizado como goma impermeable hasta su sustitución por las gomas sintéticas derivadas del petróleo.
La trementina es una sustancia que se obtiene de la destilación de la resina del pino y que se utiliza de forma industrial como disolvente de pinturas, desinfectante y para fabricar compuestos aromáticos.
MAYO 15 DE 2013
PROYECTO: LABORATORIO EN CASA
INDICACIONES: Desarrollar en cartelera para explicarlo en clase y tomar fotos de cada proceso elaborado, fecha de exposición para el próximo miércoles
Materiales:
2 flores blancas o amarillas
Azul de metileno
2 vasos transparentes
Agua
Lámpara o foco de mano
PROCEDIMIENTO:
1. Adiciona agua a los vasos hasta la tercera parte de su capacidad, márcalos como 1 y 2.
2. Añade 3 o 4 gotas de azul de metileno a cada vaso.
3. Coloca una de las flores por 30 minutos aproximadamente al aire libre y cerca de la lámpara encendida.
4. Pasado el tiempo, introduce la flor en el tubo 1.
5. Ubica la otra flor en el otro vaso
6. Observa y registra los resultados.
PREGUNTAS
1. ¿Cúal es la finalidad del azul de metileno? Explica
2. ¡Para qué se acerca ala lámpara encendida? Explica
MAYO 14 DE 2013
CIRCULACIÓN EN PLANTAS Y ANIMALES
CIRCULACIÓN EN PLANTAS
El desarrollo de un sistema circulatorio, de complejidad creciente en las distintas formas de vida, es una prueba de los mecanismos de la evolución. En los organismos celulares simples, como la ameba y el paramecio, la función de transporte está asegurada sencillamente por las corrientes de material protoplasmático, que absorben o expulsan sustancias. Pero ya en las talófitas o algas, se observa la presencia de vías circulatorias. Los vegetales terrestres necesitan asegurar sus recursos hídricos, y para ello cuentan con tejidos de absorción y conducción de agua y nutrientes. Los helechos, las más evolucionadas entre las plantas inferiores, muestran perfectamente diferenciados los tejidos de conducción.
Para la circulación de la savia, la planta cuenta con dos tipos de tejido: xilema y floema. Sus elementos de conducción se asocian con tejidos de sostén y parenquimáticos (que almacenan reservas), generalmente, están agrupados formando hacecillos conductores. El xilema es leñoso, con células muertas especializadas que forman vasos conductores, unidos entre sí. El floema está formado por células vivas unidas entre sí por orificios. Estos tejidos están ubicados de distinta manera en los diversos órganos de la planta.
La savia es una mezcla de sustancias orgánicas e inorgánicas, integrada en un 98% por agua -el porcentaje varía según las distintas especies-, y en el resto por sales, azúcares, aminoácidos y hormonas. La savia bruta, compuesta por agua y sales minerales disueltas, absorbidas por la raíz, sube por el xilema y alcanza las partes de la planta donde se realiza la fotosíntesis, es decir, la transformación de los minerales en materias que el organismo necesita. A través del proceso de la fotosíntesis, la savia bruta se convierte en savia elaborada, compuesta por sustancias producidas en el metabolismo, que descienden por los orificios del floema y se distribuye en toda la planta.
Entre los minerales necesarios para las plantas, los de mayor valor son el nitrógeno, requerido para la multiplicación celular; el fósforo, que integra compuestos ricos en energía; el potasio, que favorece la asimilación de sustancias nutritivas; el calcio, que une y protege las células; el cobre, de valor durante el período de crecimiento; el cinc, que interviene en la formación de los líquidos, y el manganeso, en la de sustancias proteicas. Además, requiere magnesio, ya que ese elemento interviene en la formación de clorofila, pigmento que interviene en la fotosíntesis.
CIRCULACIÓN EN ANIMALES
Te invito a entrar en el siguiente link:
ABRIL 22 DE 2013
SUGERENCIAS ACERCA DE CÒMO REALIZAR EL MODELO MOLECULAR EN QUÌMICA.
Esta es una idea para que lo elabores en casa, también, puedes visitar el link: http://descubrirlaquimica.wordpress.com/moleculas-vamos-a-hacernos-una-idea-de-como-son/
ABRIL 18 DE 2013
QUÍMICA
PARA TENER EN CUENTA: lee el siguiente párrafo y luego consígnalo en tu cuaderno, para la próxima clase presentar Tabla Periódica.
LA TABLA PERIÓDICA
Cada elemento, representado por un símbolo y número atómico, ocupa un cuadro separado, y la disposición secuencial sigue el orden del número atómico.
La tabla divide los elementos en nueve grupos, designados por encabezamientos numéricos en cada columna, y en siete periodos.
Siete de los nueve grupos se suelen dividir, además, en las categorías a y b; los elementos a se clasifican como grupo principal y los b como subgrupo.
Dos hileras (lantánidos o tierras raras y actínidos) ocupan posiciones especiales fuera del cuerpo principal de la tabla, porque no pueden ser incluidos de manera adecuada en los periodos seis y siete. Los elementos que siguen al laurencio (número atómico 103) se cree que se incluirán en un tercer grupo, el grupo super-actínido, fuera del cuerpo principal de la tabla periódica.
En general, los elementos de un mismo grupo exhiben una valencia semejante. La tabla periódica efectúa también una división natural de los elementos en su estado elemental o no combinado en metales y no metales.
Entre el área ocupada por los elementos meramente metálicos y la ocupada por los no metales hay un límite mal definido de elementos cuyas propiedades son transicionales entre los elementos metálicos y los no metálicos. A estos elementos indefinidos se les llama metaloides.
Hay muchos otros ejemplos del inmenso poder correlativo de la disposición de la tabla periódica, a saber: potencial de oxidación, calor de formación de compuestos tipo, conductividad eléctrica, punto de fusión, punto de ebullición, radio iónico, potencial de ionización, afinidad electrónica, espectro óptico y comportamiento magnético.
Pocas sistematizaciones en la historia de la ciencia pueden rivalizar con el concepto periódico como una revelación total del orden del mundo físico. En el patrón rítmico de las propiedades de los elementos, las unidades arquitectónicas del universo no cambian en forma caprichosa o completamente nueva.
De descubrirse un elemento nuevo en el futuro, éste deberá ocupar un lugar en el sistema periódico que esté de acuerdo con el orden y exhibirá las propiedades características conocidas.
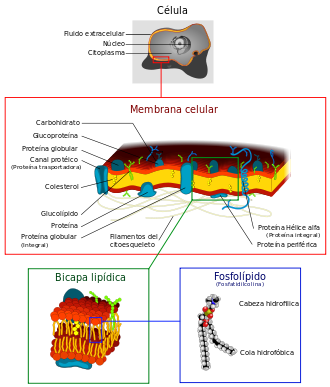
ABRIL 17 DE 2013
MEMBRANA PLASMÀTICA
Funciones
- La función principal de la membrana plasmática es mantener el medio interno separado del externo. Esto es posible gracias a la naturaleza aislante en medio acuoso de la bicapa fosfolipídica y a las funciones de transporte que desempeñan las proteínas. La combinación de transporte activo y transporte pasivo hacen de la membrana endoplasmática una barrera selectiva que permite a la célula diferenciarse del medio.
- Permite a la célula dividir en secciones las distintas orgánelas y así proteger las reacciones químicas que ocurren en cada uno.
- Crea una barrera selectivamente permeable en donde solo entran o salen las sustancias estrictamente necesarias.
- Transporta sustancias de un lugar de la membrana a otro, ejemplo, acumulando sustancias en lugares específicos de la célula que le puedan servir para su metabolismo.
- Percibe y reacciona ante estímulos provocados por sustancias externas (ligandos).
- Mide las interacciones que ocurren entre células internas y externas.
Permeabilidad
La permeabilidad de las membranas es la facilidad de las moléculas para atravesarla. Esto depende principalmente de la carga eléctrica y, en menor medida, de la masa molar de la molécula. Moléculas pequeñas o con carga eléctrica neutra pasan la membrana más fácilmente que elementos cargados eléctricamente y moléculas grandes. Además, la membrana es selectiva, lo que significa que permite la entrada de unas moléculas y restringe la de otras. La permeabilidad depende de los siguientes factores:- Solubilidad en los lípidos: Las sustancias que se disuelven en los lípidos (moléculas hidrófobas, no polares) penetran con facilidad en la membrana dado que está compuesta en su mayor parte por fosfolípidos.
- Tamaño: la mas grande parte de las moléculas de gran tamaño no pasan a través de la membrana. Sólo un pequeño número de moléculas polares de pequeño tamaño pueden atravesar la capa de fosfolípidos.
- Carga: Las moléculas cargadas y los iones no pueden pasar, en condiciones normales, a través de la membrana. Sin embargo, algunas sustancias cargadas pueden pasar por los canales proteicos o con la ayuda de una proteína transportadora.
- Canales: algunas proteínas forman canales llenos de agua por donde pueden pasar sustancias polares o cargadas eléctricamente que no atraviesan la capa de fosfolípidos.
- Transportadoras: otras proteínas se unen a la sustancia de un lado de la membrana y la llevan al otro lado donde la liberan.
Uso del término membrana celular
La expresión membrana celular se usa con dos significados diferentes:- Membrana plasmática, descrita en el presente artículo, es la membrana que siempre envuelve al citoplasma de las células. Aunque este uso siempre fue ilegítimo, está extraordinariamente extendido, sobre todo en los textos de habla inglesa (cell membrane).
- Pared celular, también llamada membrana de secreción, es una cubierta más o menos resistente que cubre a todas o la mayoría de las células de las plantas, los hongos y los protistas pluricelulares.
MARZO 7 DE 2013
EVALÚA TUS COMPETENCIAS
1. Redacta tres ideas concretas sobre el tema de las moléculas de la vida.
2. ¿ Qué tipo de biomolècula es más importante para el organismo?. Explica.
3. ¿Por qué razón las personas que padecen de diabetes deben consumir alimentos bajos en glùcidos?
4. De los productos observados, cuál es el más completo a nivel nutricional.
5. ¿ Qué diferencias hay entre un alimento empacado y otro obtenido en un ambiente natural?.
FEBRERO 20 DE 2013
ANÁLISIS DE RESULTADOS DEL LABORATORIO.
NOTA: RECUERDA DIBUJAR Y DESCRIBIR LO QUE SE OBSERVO DURANTE LA EXPERIENCIA EN EL LABORATORIO.
Resuelve las preguntas en tu cuaderno de trabajo:
a. ¿Qué diferencia encontraste en cada tubo?
b. ¿Qué biomoléculas tiene la clara de huevo?
c. ¿Qué biomoléculas constituyen el jugo de manzana?
d. Para qué se utiliza el reactivo de Benedict.
FEBRERO 13 DE 2013
COMPROMISO
Observa, dibuja la imágen del fósil celular y su importancia consignándola en tu cuaderno:
b.- Eón
ARCAICO (3.800 a 2.500 ma):
| |||||||
FEBRERO 8 DE 2013
BIENVENIDOS JÓVENES A ESTA NUEVA EXPERIENCIA.
A CONTINUACIÓN OBSERVA LO SIGUIENTE EN EL LINK:
http://www.youtube.com/watch?v=K9Rq4ZBx-
NOVIEMBRE 28 DE 2012
Pequeños hábitos que pueden cambiar nuestro destino ¡Ahorremos agua!!!
PLAN DE 3 PASOS PARA ASEGURAR EL SUMINISTRO DE AGUA
1. Ahorrar agua. Por lo menos UN LITRO de agua al día.
2. Tomar acción. Comprometerte y hacer que tu familia se comprometa también a ahorrar por lo menos UN LITRO de agua diario.
3. Circular este mail. Pasar este mail a todos tus conocidos para sumar a este movimiento el mayor número de personas.
Si logramos que 30 millones de colombianos ahorren un litro de agua diario, serán 30 MILLONES DE LITROS DIARIOS y 10.950 MILLONES DE LITROS AL AÑO!!!
!!!EL AGUA ES VITAL PARA LA SUPERVIVENCIA HUMANA!!!
FORMAS DE AHORRAR POR LO MENOS UN LITRO DE AGUA AL DÍA
*Si conoces otras formas de ahorro de agua, por favor anótalas aquí.
**Si puedes ahorrar más de un litro al día, muchos COLOMBIANOS te lo agradeceremos
*** Intenta ahorrar un litro adicional por cada inconsciente que crea que este asunto no es de carácter vital.
DATOS RELEVANTES SOBRE EL AGUA
· Cada vez que vamos al baño y jalamos la palanca, estamos consumiendo la misma cantidad de agua que un africano consume en todo un día.
· El consumo anual de agua de un ser humano varía entre 2.5 millones de litro (EUA) hasta 1,500 litros en algunos países de África.
· De cada cuatro personas una no alcanza el agua pura.
· La producción de una camiseta de algodón requiere de 2,900 litros de agua.
· Cada ocho segundos muere un niño por beber agua contaminada.
· Más de cinco millones de personas mueren cada año por aguas contaminadas.
· En el año 2030 harían falta dos planetas para mantener el estilo de vida actual de la humanidad.
· 2 mil millones de personas en el mundo, la tercera parte, sufren de escasez de agua potable.
· Una de cada seis personas carece de un acceso regular al agua potable.
· Más del doble, 2.400 millones de personas, no dispone de servicios de saneamiento adecuados.
· Las enfermedades vinculadas con el agua provocan la muerte de un niño cada ocho segundos y son la causa del 80% del total de las enfermedades y muertes en el mundo en desarrollo, situación que resulta mucho más trágica si se tiene en cuenta que desde hace mucho tiempo sabemos que esas enfermedades se pueden prevenir fácilmente..
· Si bien en los últimos 20 años el mundo en desarrollo ha presenciado un aumento del suministro de los servicios de agua, ese adelanto se vio contrarrestado en gran parte por el crecimiento demográfico.
· Se ha estimado que un ser humano necesita en promedio 50 litros de agua por día para beber, cocinar, lavar, cultivar, sanear. Pero el derecho al agua, básico para cualquier criatura, empieza a llegar gota a gota a millones de personas.
· Y este sonido de emergencia hace sólo unos años (el Foro Mundial del Agua celebró en marzo reciente su tercera versión, en Kioto, Japón) empezó a ser considerado internacionalmente como una constatación pavorosa de vertiginosa escasez de agua en todo el planeta, surgida no sólo del crecimiento poblacional, sino de la estremecedora negligencia humana con todas sus consecuencias relacionadas.
· El primer Foro Mundial del Agua celebrado en el año 2000 en La Haya, se fijó como objetivo para el año 2015 reducir a la mitad el número de personas sin acceso al agua potable. Pero no incluyó planes para evitar su monopolio. Apenas sí se nombró el conflicto de la privatización de las fuentes de agua, destinado a ser uno de los más graves del siglo que empieza.
· Pese a que sólo el 5% del agua potable en el mundo está en manos privadas, las ganancias anuales que obtienen estas empresas son más del doble de lo que gana hoy la industria petrolera.
NOVIEMBRE 13 DE 2012
OCTUBRE 30 DE 2012
PARA DISCUTIR:

Visita el siguiente link y escribe un comentario en tu cuaderno, para que puedas participar en la clase:
http://www.youtube.com/watch?v=3I5LrP6YJLA&feature=related
OCTUBRE 22 DE 2012
LOS ECOSISTEMAS EN COLOMBIA
SEPTIEMBRE 24 DE 2012
ACTIVIDAD DE QUÍMICA
De acuerdo a lo realizado en clase consulta lo siguiente y luego deja un comentario:
* Qué instrumentos son los utilizados para determinar:
a. Densidad (Dibujo de aparato)
b. Calor (Dibujo de aparato)
c. Mol (Dibujo de aparato)
* Visita el siguiente link y comenta al final.
http://www.youtube.com/watch?v=qkbBgjgGj8k
AGOSTO 27 DE 2012
ACTIVIDAD DE QUÍMICA
Teniendo en cuenta lo realizado en clases, realiza los ejercicios siguientes:
H: ______________________ Spines: ______________________
He: _____________________ Spines: ______________________
C:______________________ Spines: _______________________
N: ______________________ Spines: ______________________
O: ______________________ Spines: ______________________
AGOSTO 8 DE 2012
CLUB DE CIENCIAS
Queridos estudiantes pueden seguir el siguiente link, para que realicen e experimento:
http://www.youtube.com/watch?feature=endscreen&NR=1&v=1ibeIFv8ORc
JULIO 16 DE 2012
COMPROMISO DE QUÍMICA
- Las siguientes preguntas las desarrollarás en tu cuaderno de trabajo y te prepararás para una evaluación corta sobre ellas.
1. ¿Cuál es la forma de los orbitales y cómo se representan?
2. ¿Qué es la mecánica cuántica?
3. Escribe los nombres de los científicos que plantearon la mecánica cuántica.
4. Realiza las ilustraciones o figuras geométricas respectivas de los orbitales teniendo en cuenta los ejes cartesianos.
5. Compara la situación de los orbitales, electrones y núcleo con las de tu colegio.
MAYO 7 DE 2012
ACTIVIDAD EN CASA QUÍMICA: escriba el siguiente texto en su cuaderno de trabajo y escriba un comentario.
Periodos, grupos, familias, bloques y clases de elementos en la tabla periódica.
PERIODOS.- Son los renglones o filas horizontales de la tabla periódica. Actualmente se incluyen 7 periodos en la tabla periódica.
GRUPOS.- Son las columnas o filas verticales de la tabla periódica. La tabla periódica consta de 18 grupos. Éstos se designan con el número progresivo, pero está muy difundido el designarlos como grupos A y grupos B númerados con con números romanos. Las dos formas de designarlos se señalan en la tabla periódica mostrada al inicio del tema.
CLASES.- Se distinguen 4 clases en la tabla periódica:
| ELEMENTOS REPRESENTATIVOS: | Están formados por los elementos de los grupos "A". |
| ELEMENTOS DE TRANSICIÓN: | Elementos de los grupos "B", excepto lantánidos y actínidos. |
| ELEMENTOS DE TRANSICIÓN INTERNA: | Lantánidos y actínidos. |
| GASES NOBLES: | Elementos del grupo VIII A (18) |

FAMILIAS.- Están formadas por los elementos representativos (grupos "A") y son:
GRUPO
|
FAMILIA
|
I A
| Metales alcalinos |
II A
| Metales alcalinotérreos |
III A
| Familia del boro |
IV A
| Familia del carbono |
V A
| Familia del nitrógeno |
VI A
| Calcógenos |
VII A
| Halógenos |
VIII A
| Gases nobles |
BLOQUES.- Es un arreglo de los elementos de acuerdo con el último subnivel que se forma.
| BLOQUE "s" | GRUPOS IA Y IIA | |
| BLOQUE "p" | GRUPOS III A al VIII A | |
| BLOQUE "d" | ELEMENTOS DE TRANSICIÓN | |
| BLOQUE "f" | ELEMENTOS DE TRANSICIÓN INTERNA |






























me parecio muy interesante la lectura ya que nos enseña cuales son los periodos grupos y demas elementos de la tabla periodica :)
ResponderEliminarseño esto es muy curioso porque es algo q yo no sabia, y me parece interesante
ResponderEliminarseño divina me pareció muy interesante divertido ya que pude comprender mas sobre la tabla periódica su periodos grupos y de mas.
ResponderEliminargracias
Seño me pareció muy didáctica e interesante ya que desde esta lectura podemos saber los periodos grupos y demas de la tabla periodica
ResponderEliminarSeño Me Pareció Muy Interesante En el sentido que aprendí sobre sus periodos sus clases los grupos los metales que ellos se dividen en metales y metales de transición pude conocer mas sobre la tabla periódica =)
ResponderEliminarkarina atencio:
ResponderEliminarme pareció muy bacano esta lectura ya que nos ayuda a sabre un poco mas de la tabla periódica como se divide y en cuanto se divide los grupos y saber un poco mas de los bloques,familia,y clase de elemento de la tabla periódica
Jorge Silvera Soñet ♥
ResponderEliminarSeño Me PareCio Muy Interesante Este Tema por que aprendí sobre sus periodos sus clases los grupos los metales que ellos se dividen en metales y metales de transición pude conocer mas sobre la tabla periódico :)
Me parecio interesante, puede comprender mejor el tema visto en clase.
ResponderEliminarme parecio bien poque sabemos mas sobre ella
ResponderEliminarme parecio muy interesante el video de las medidas de la masa, los instrumentos
ResponderEliminarmuchassss gracias :)
:D
ResponderEliminarbakno ese video de la medicion de masas con balanzas
ResponderEliminarme gust y aprendi
Gracias :)
:3
estuvo muy interesante el video sobre la medicion de las masas y como es su procesos para pesarla
ResponderEliminarEl video estubo muy bueno pq nos mostro como se miden las sustancias.
ResponderEliminara mi me gusto este video ya que nos esplica como se mide las sustancia y me ayudo a saber un poco mas de lo que no sabia
ResponderEliminarSeño em parecio muy interesante el video porque Aprendi como se miden las sustancias
ResponderEliminar